nat. metab.(IF=20.8)|北医三院徐明教授团队:TGR5抑制脂肪酸摄取预防糖尿病性心肌病的机制新解

英文标题:Inhibition of fatty acid uptake by TGR5 prevents diabetic cardiomyopathy
中文标题:TGR5通过抑制脂肪酸摄取可预防糖尿病性心肌病
发表期刊:nature metabolism
影响因子:20.8
研究背景
糖尿病性心肌病(Diabetic Cardiomyopathy, DbCM)的核心特征为心肌脂质堆积与心功能障碍,而代谢失衡尤其是脂质代谢紊乱在其中起关键作用。脂肪酸作为心脏主要能量底物,其代谢异常(如摄取、合成与消耗失衡)可引发细胞脂毒性并破坏能量供应。CD36作为主要脂肪酸转运蛋白,在糖尿病中过度活跃导致脂肪酸摄取增加,但具体调控机制尚不明确。胆汁酸代谢通过受体TGR5参与多种代谢疾病调节,且糖尿病患者及动物模型中存在胆汁酸水平异常。尽管已知TGR5在心脏中表达并参与心肌保护,但其通过胆汁酸信号调控心脏代谢稳态、尤其是与CD36介导的脂肪酸摄取之间的关联仍不清晰。基于此,本研究聚焦TGR5在DbCM中的作用,探索其对心肌脂质代谢的调控机制及治疗潜力。
技术路线
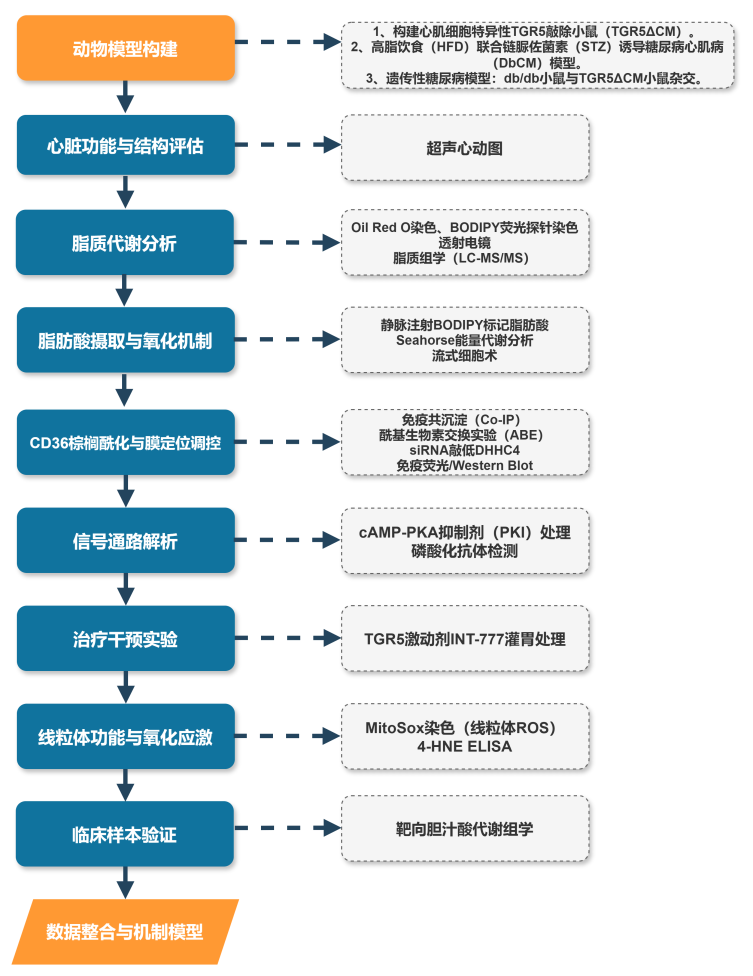
研究结果
1、心脏特异性TGR5缺失加重心功能障碍
通过构建两种DbCM小鼠模型——HFD/STZ诱导型(处理24周)和db/db遗传型(TGR5ΔCM小鼠与同窝对照),探究胆汁酸代谢物DCA及其受体TGR5在糖尿病性心脏损伤中的作用(图1)。HFD/STZ模型中,小鼠血浆和心脏组织中DCA水平显著下降(图1b-c),伴心肌肥大(心房利钠肽ANP、脑利钠肽 BNP、β-肌球蛋白重链β-MHC蛋白水平升高,图1l-m)和纤维化(图1i-k);db/db遗传模型中,TGR5ΔCM小鼠较对照(db/db TGR5fl/fl)表现出更严重的心功能恶化。
心脏特异性敲低TGR5(TGR5ΔCM)未显著改变体重、血糖、胰岛素等基础代谢指标,但导致收缩/舒张功能恶化:HFD/STZ诱导的TGR5ΔCM小鼠左室整体纵向应变(GLS)、射血分数(EF)、缩短分数(FS)显著下降,舒张功能指标E/E’比值升高(图1d-h),且在雄性和雌性小鼠中结果一致。组织学显示,TGR5缺失加重心肌细胞肥大(图1j)和纤维化(图1k)。两种模型均证实,TGR5缺失特异性加剧DbCM表型,提示其在糖尿病心脏保护中的关键作用(图1i-m)。
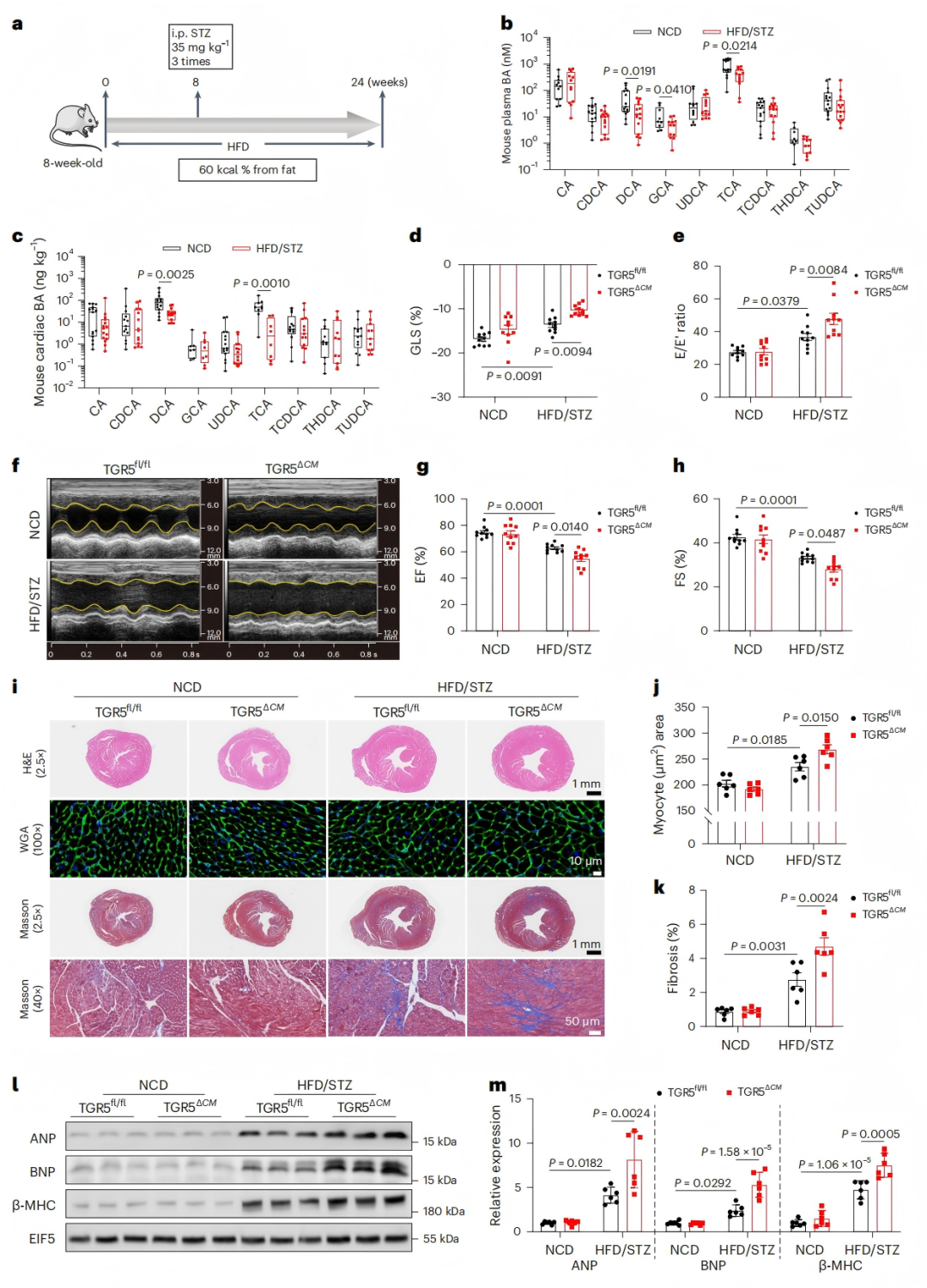
图1. 心脏特异性缺失TGR5会加重HFD/STZ诱导的DbCM小鼠的心功能障碍和重构
2、TGR5缺失促进心肌脂质积累
为探究心功能障碍的潜在机制,研究者评估了心肌脂质代谢水平。在HFD/STZ诱导的TGR5fl/fl小鼠和db/db遗传模型小鼠(db/db TGR5fl/fl)中,TGR5ΔCM小鼠心肌脂质积累显著增加:Oil Red O染色和BODIPY 493/503荧光染色显示中性脂质沉积增多(图2a-c),心肌TG水平升高(图2d);原代心肌细胞实验表明,TGR5ΔCM细胞经棕榈酸+油酸(PA+OA)处理后,脂滴荧光强度增加(图2e)。透射电镜(TEM)显示,TGR5ΔCM小鼠心肌脂滴数量增加、直径增大(图2f-h)。
脂质组学分析显示,TGR5ΔCM小鼠心脏组织中FFA、DG、TG水平显著上调(图2i-j),长链不饱和脂肪酸(如C18:1、C20:2)比例显著升高(图2k)。两种糖尿病模型均表明,TGR5缺失通过促进脂肪酸摄取和储存,导致心肌脂质过度积累(图2a-k),为DbCM的脂毒性机制提供了直接证据。
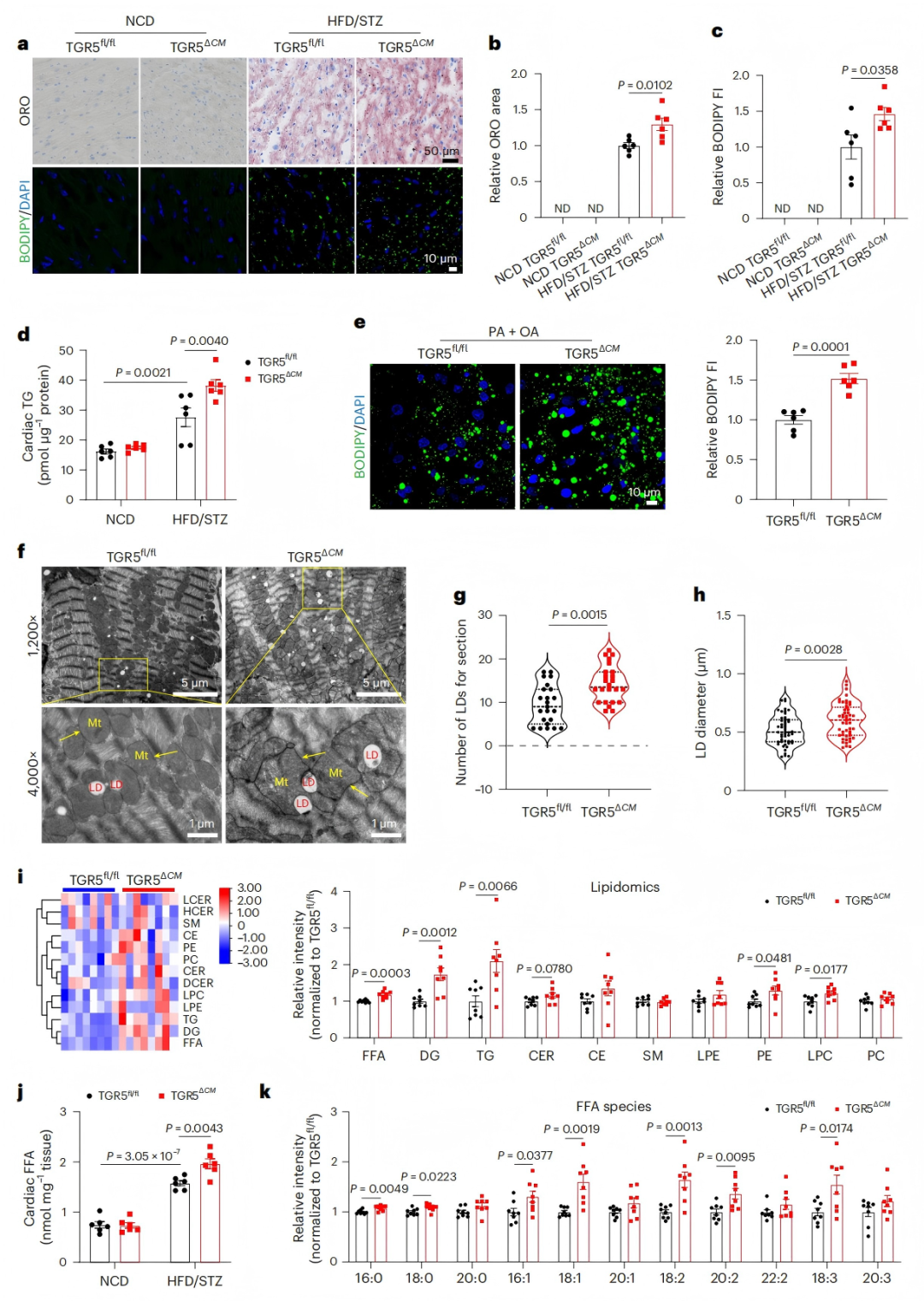
图2. TGR5缺失促进HFD/STZ诱导的DbCM小鼠心肌脂质积累
3、激活TGR5可预防心功能障碍和心脂毒性
为了评估TGR5对预防心脏脂毒性的影响,研究者给db/db小鼠灌胃TGR5激动剂INT-777。处理12周后,db/db小鼠心脏收缩和舒张功能显著提升,但这一效果在TGR5缺失的db/db TGR5ΔCM小鼠中消失,表明TGR5是功能改善的必要条件(图3a-e)。INT-777治疗显著减轻db/db小鼠心肌细胞肥大和纤维化,并减少心肌脂质积累,但上述效应同样依赖于TGR5的存在(图3f-j)。脂质组学显示,INT-777处理的db/db小鼠心肌中FFA、DG和TG水平显著降低,长链不饱和脂肪酸含量减少(图3k-m)。这些结果表明,TGR5激活可能抑制心肌脂质积累,提示TGR5是一个潜在的治疗靶点,激活TGR5是糖尿病性心肌病的潜在治疗靶点。
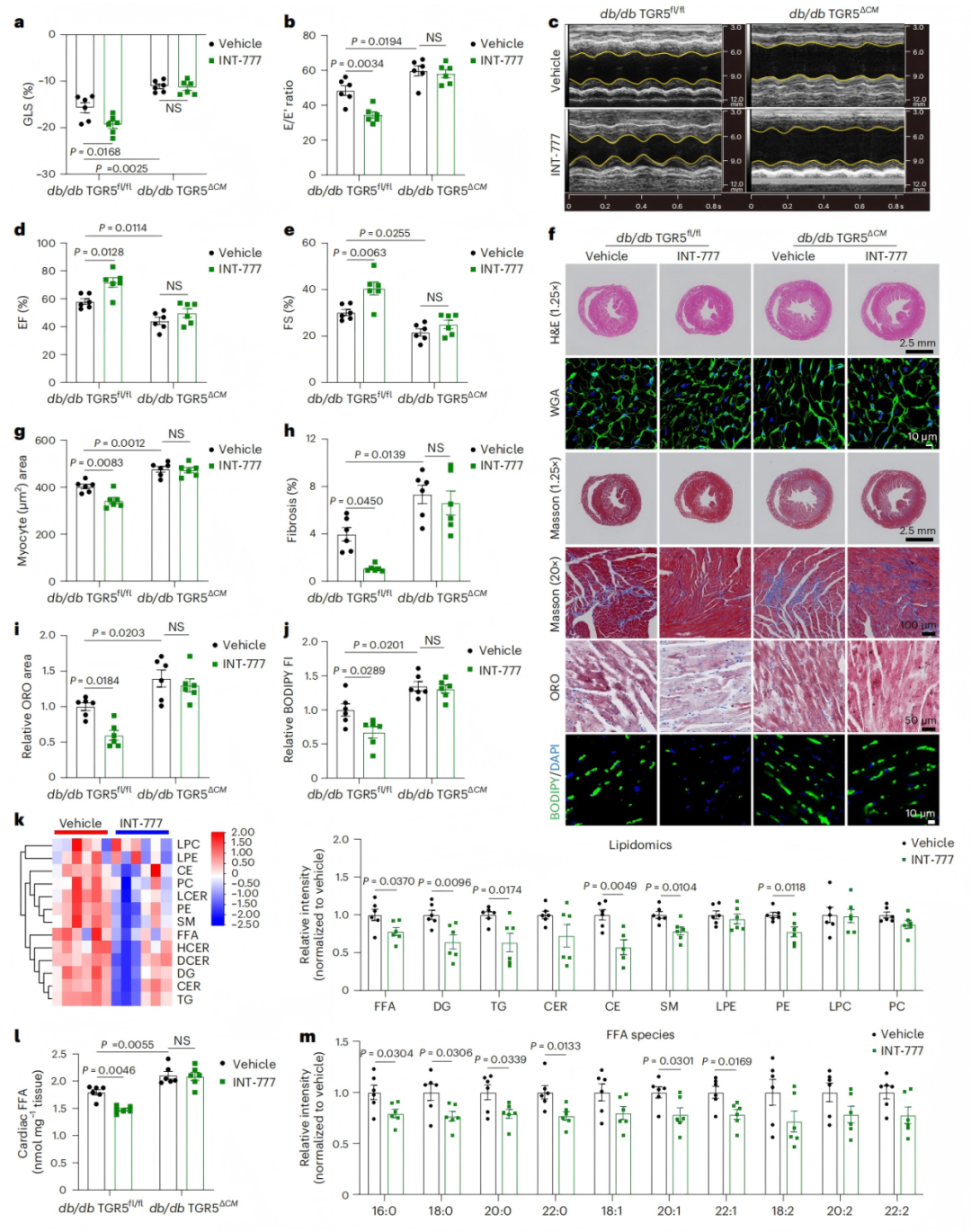
图3. TGR5特异性激动剂INT-777可预防db/db小鼠心功能障碍和心脂毒性
4、TGR5抑制脂肪酸摄取和CD36的质膜定位
为探究TGR5对心脏脂质代谢的调控机制,研究者评估了脂肪酸摄取和脂肪酸氧化(FAO)功能。通过静脉注射BODIPY荧光共轭脂肪酸,发现糖尿病TGR5ΔCM小鼠心肌组织对长链脂肪酸(如BODIPY C16)的摄取显著增加,而TGR5激动剂INT-777治疗可明显减少该摄取(图4a-c)。体外实验进一步证实,TGR5缺失的原代心肌细胞对脂肪酸的摄取增强,INT-777处理则抑制这一过程(图4d-e)。在FAO方面,TGR5缺陷心肌细胞对外源性脂肪酸的利用减少,导致基础呼吸和最大呼吸能力下降,提示TGR5通过抑制脂肪酸摄取维持心肌细胞的FAO和线粒体功能。
CD36作为心脏长链脂肪酸摄取的主要调节因子,其功能依赖于质膜(PM)定位。研究发现,TGR5ΔCM小鼠心肌中CD36的质膜定位显著增加,而INT-777 治疗可降低其定位(图4g-h)。机制上,TGR5缺失促进CD36与Src家族激酶Fyn和Lyn的结合,形成信号复合物(图4j-l),INT-777治疗则逆转这一效应(图4m-o)。这些结果表明,TGR5通过抑制CD36-Fyn-Lyn复合物的组装,减少CD36质膜定位,从而抑制脂肪酸摄取,解释了TGR5ΔCM小鼠心脏脂毒性的机制。
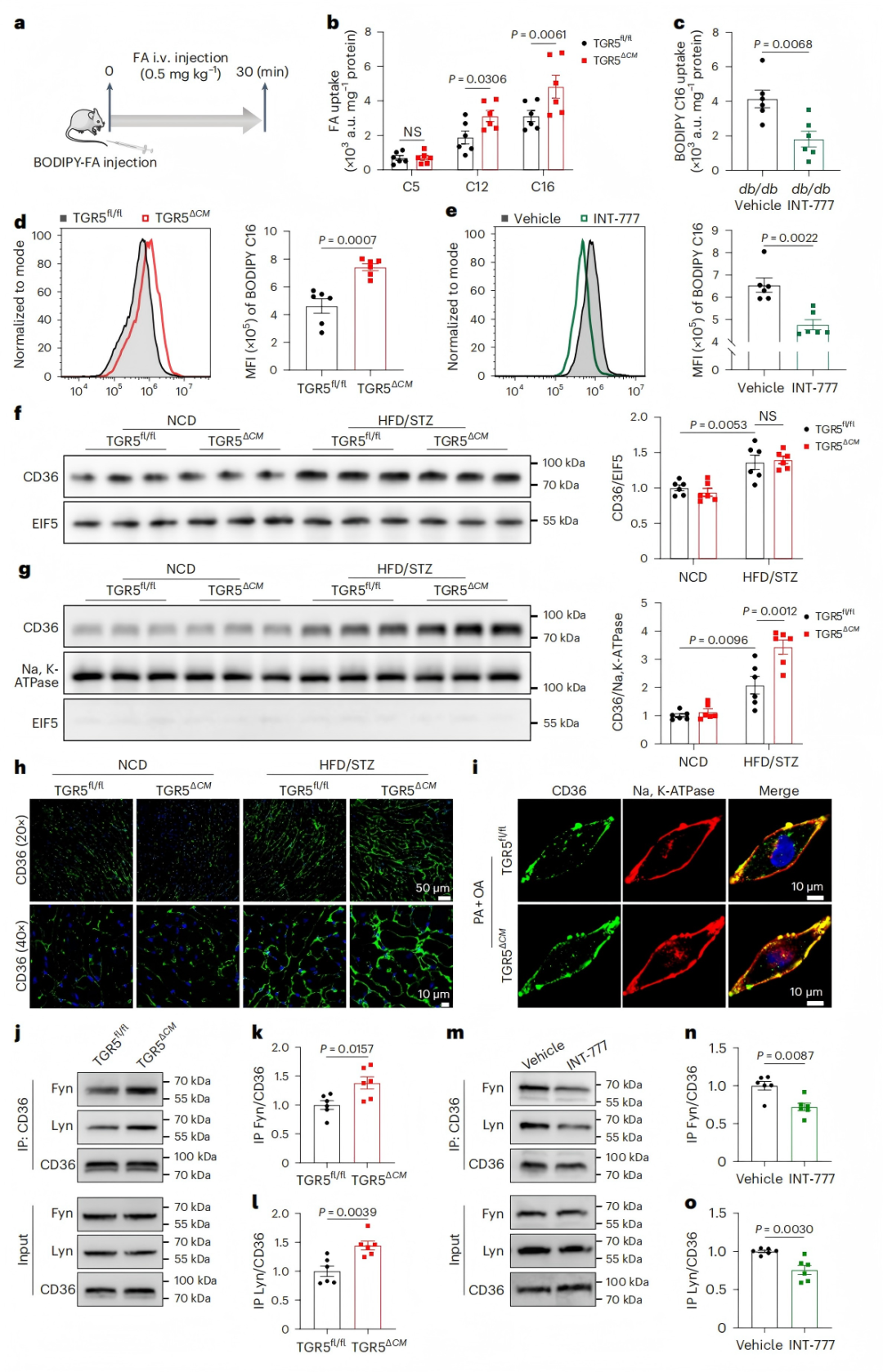
图4. TGR5减少长链脂肪酸摄取和CD36在心肌细胞PM上的定位
5、TGR5-DHHC4信号调控CD36棕榈酰化
棕榈酰化是一种关键的翻译后修饰,通过增强亲脂性调节蛋白质的亚细胞分布和功能。鉴于其与膜蛋白质膜定位的关联,研究者利用酰基生物素交换(ABE)分析法,检测HFD/STZ诱导和db/db糖尿病小鼠心脏中CD36的棕榈酰化水平。结果显示,糖尿病小鼠心脏中棕榈酰化CD36水平显著升高,且在HFD/STZ诱导的糖尿病模型中,TGR5ΔCM小鼠的CD36棕榈酰化水平较TGR5fl/fl小鼠进一步升高(图5a-b)。TGR5受体激动剂INT-777可显著降低CD36棕榈酰化水平(图5c)。使用2-溴棕榈酸(2-BP)抑制棕榈酰化后,心肌细胞的脂肪酸摄取和脂质积累显著减少,表明TGR5通过抑制CD36棕榈酰化发挥作用(图5d-f)。
CD36棕榈酰化主要由棕榈酰转移酶DHHC4介导(DHHC5无显著作用)。机制上,TGR5缺失增强了CD36与DHHC4的结合,而INT-777处理可抑制该结合(图5g-i)。敲低DHHC4(siDHHC4)后,CD36棕榈酰化水平显著降低,证实DHHC4是CD36棕榈酰化的关键调控因子,且TGR5对CD36棕榈酰化的调控依赖于DHHC4(图5j)。此外,TGR5通过cAMP-PKA信号通路发挥作用:INT-777激活内源性PKA,促进DHHC4磷酸化,而PKA抑制剂(PKI)可完全阻断这一效应。这些数据表明,TGR5-DHHC4信号通路通过调控CD36棕榈酰化,影响心肌细胞的脂肪酸摄取和脂质积累。
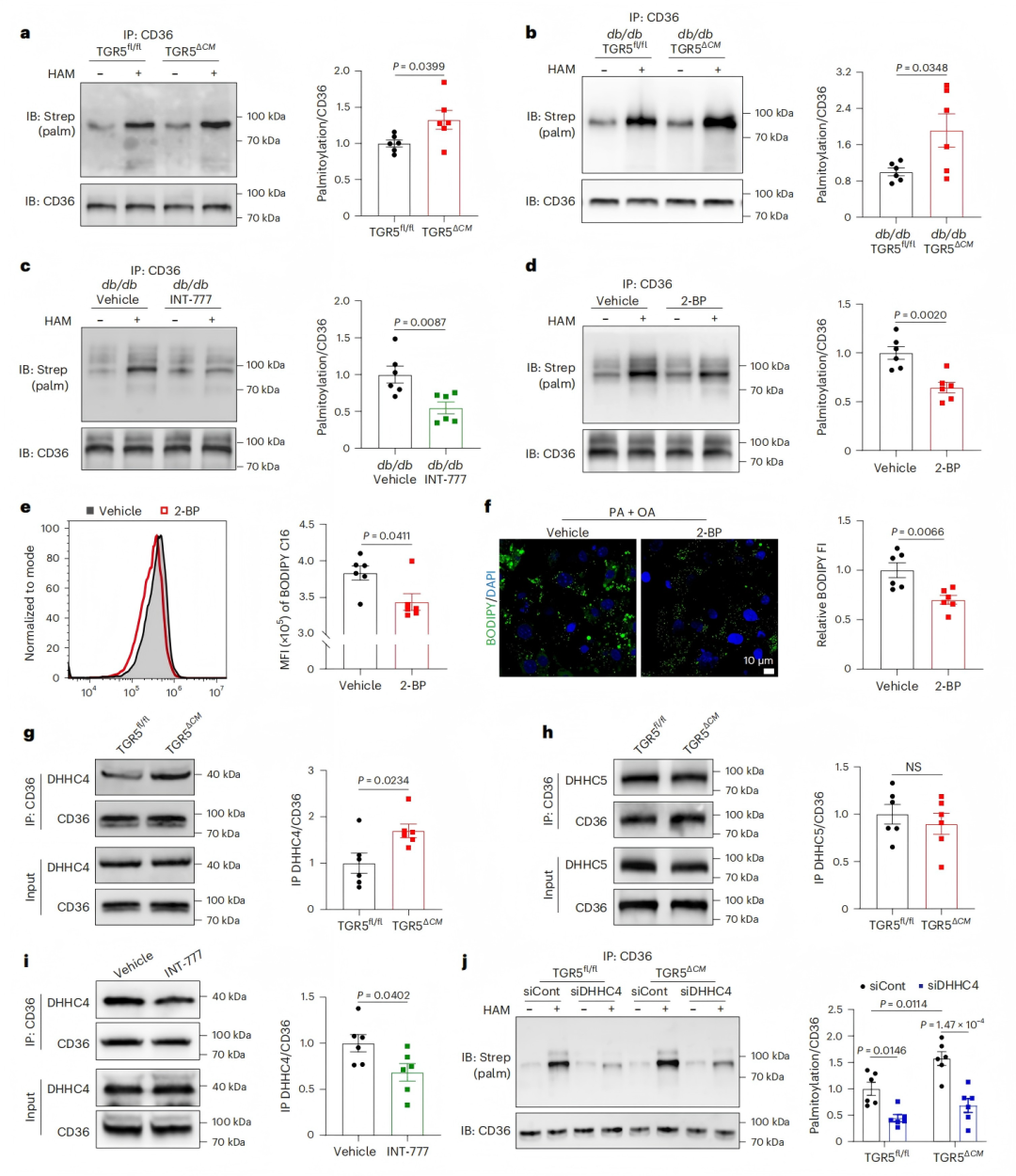
图5. TGR5通过DHHC4抑制CD36棕榈酰化
6、DHHC4敲低可缓解TGR5缺陷小鼠的心功能障碍
为验证DHHC4在TGR5缺失导致心功能障碍中的作用,研究者通过尾静脉输注AAV9-cTNT-DHHC4,在HFD/STZ诱导的TGR5fl/fl和TGR5ΔCM小鼠中构建心肌细胞特异性DHHC4敲低(DHHC4-KD)模型。结果显示,DHHC4-KD有效改善了HFD/STZ诱导的心脏收缩和舒张功能,显著逆转了TGR5ΔCM小鼠的心功能恶化(图6b-f)。
组织学分析表明,DHHC4-KD显著减少心肌脂质积累,Oil Red O和BODIPY 493/503染色显示脂质沉积明显降低(图6g-i)。分子机制上,DHHC4-KD 降低了CD36的棕榈酰化水平及其在质膜的定位(图6j-m),并显著减少心肌对长链脂肪酸的摄取(图6n)。这些发现证实,TGR5缺失所致的心肌脂质积累增加和心功能障碍依赖于DHHC4的激活,进一步支持TGR5-DHHC4信号通路在糖尿病性心肌病中的关键作用。
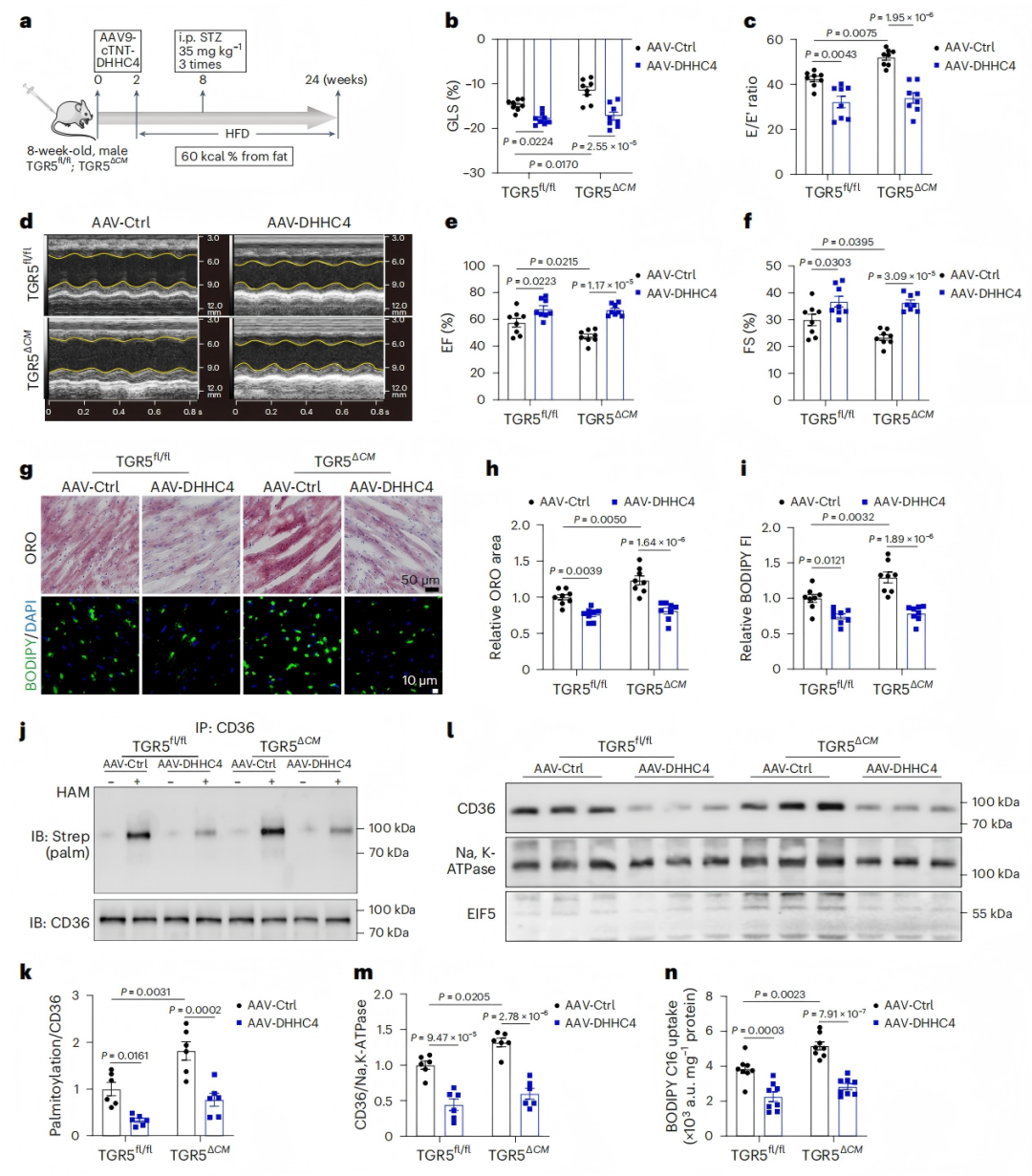
图6. DHHC4敲低可改善TGR5缺乏对HFD/STZ诱导的DbCM小鼠的有害影响
7、DCA与糖尿病心肌损伤的关系
为探究胆汁酸水平与糖尿病心肌损伤的关联,研究者对健康参与者、2型糖尿病(T2DM)合并左心室肥厚(LVH)及心力衰竭(HF)患者的血浆胆汁酸进行代谢组学分析。结果显示,T2DM合并LVH和HF患者的脱氧胆酸(DCA)、牛磺胆酸(TCA)水平显著降低,其中DCA在HF患者中下降更为明显(图7a)。性别亚组分析表明,男性和女性T2DM患者的DCA水平均显著降低,但性别间无统计学差异(图7b-d)。相关性分析显示,血浆DCA水平与N端前B型利钠肽(NT-proBNP)呈负相关(图7e),与左室射血分数呈正相关(图7f)。这些发现表明,胆汁酸-TGR5通路参与DbCM的发生发展,其相关胆汁酸水平可能作为DbCM的潜在诊断标志物。
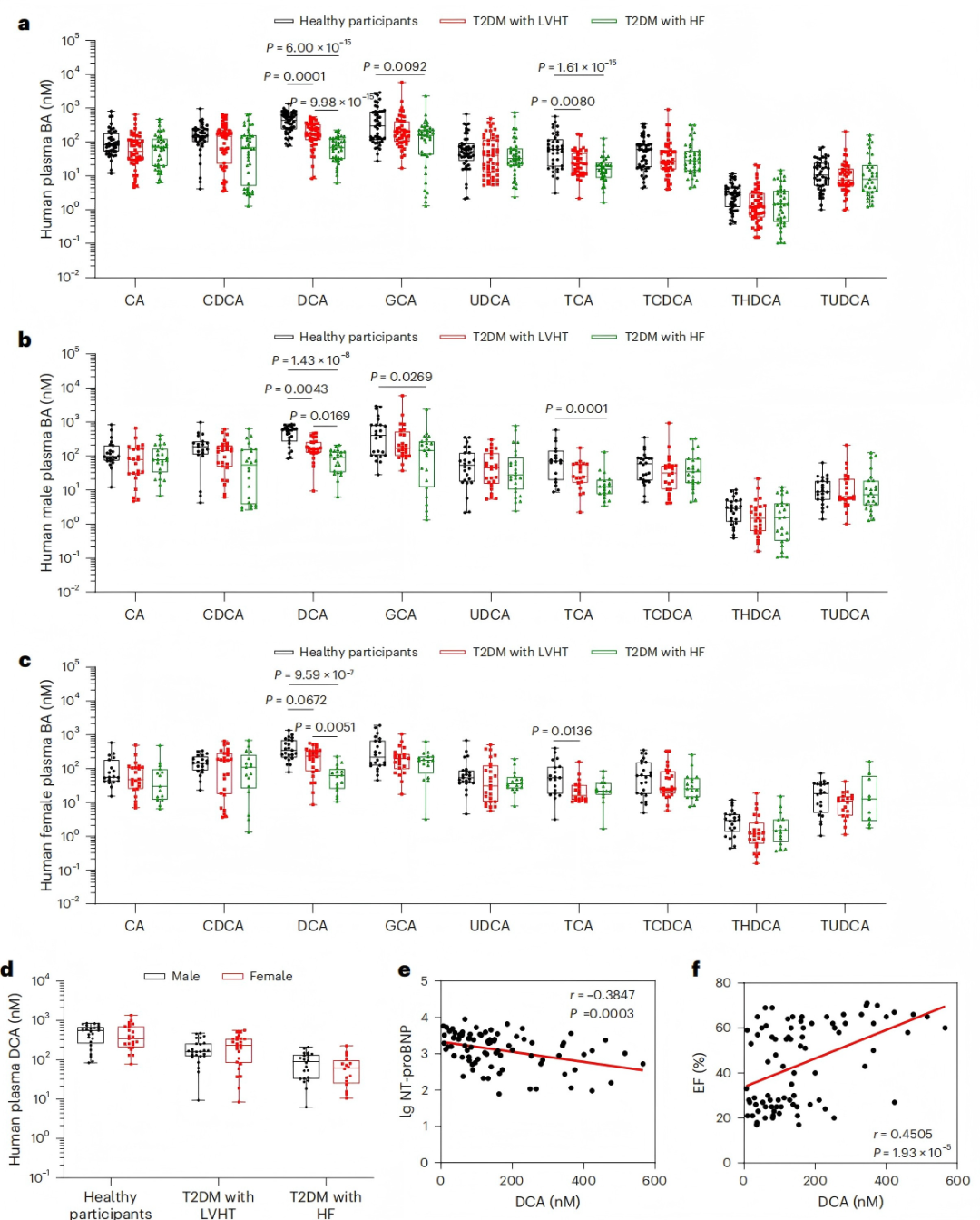
图7. TGR5偏向性胆汁酸水平降低与糖尿病心肌损伤有关
研究结论
本研究揭示了心脏脂肪酸摄取的调控新机制:胆汁酸受体TGR5可预防HFD/STZ诱导或2型糖尿病遗传模型(db/db小鼠)的DbCM发展。研究证实,TGR5通过抑制棕榈酰转移酶DHHC4介导的CD36棕榈酰化修饰,阻断CD36在质膜的定位,从而减少心肌细胞的脂肪酸摄取和脂质积累。此外,糖尿病心肌损伤小鼠及合并心力衰竭的糖尿病患者中,TGR5偏向性胆汁酸脱氧胆酸(DCA)水平显著降低,且血浆DCA水平与心脏功能指标密切相关。这些发现突出了TGR5-DHHC4通路作为DbCM保护的关键调控轴,为干预DbCM脂质代谢提供了潜在治疗靶点。
