浅谈mRNA的量与蛋白表达量不线性相关的原因(二)
本文内容速览:

在“浅谈mRNA的量与蛋白表达量不线性相关的原因(一)”这篇推文中伯远生物(https://plant.biorun.com)给大家介绍了一些影响翻译效率的因素,这些因素导致mRNA的量与蛋白表达量不线性相关。这里小远将进一步给大家介绍更多影响因素,帮助大家更好地理解mRNA与蛋白之间的变化关系。
mRNA翻译成蛋白的过程出现问题
在之前的推文中小远已经给大家介绍了3种抑制翻译的因素,包括5' UTR中存在的二级茎环结构、uORF以及miRNA对翻译的抑制作用,这里小远继续为大家补充几点因素。
01
磷酸化修饰影响翻译效率
2024年4月,国立台湾大学鄭梅君团队在Nature Communications杂志上发表了一篇题为“The phosphorylation of carboxyl-terminal eIF2α by SPA kinases contributes to enhanced translation efficiency during photomorphogenesis”的研究论文,该论文发现SPA1直接磷酸化eIF2α的C端Ser/Thr残基,从而促进蛋白翻译和光形态建成,而未磷酸化的eIF2α则抑制翻译效率,下面我们一起去看一看作者是如何研究得出该结论的。
先前的报道表明,SPAs不仅在增强COP1 E3连接酶功能中起辅助作用,而且还是磷酸化PIF1、PIF4和HY5等光信号调节因子(Paik etal., 2019;Lee et al., 2020;Wang et al., 2021)的重要激酶。由于SPAs可能参与暗-光过渡过程中的翻译调控,作者假设SPAs可能靶向并磷酸化eIF2α以调节其活性。为了验证这一假设,作者首先确定了SPA1是否能够与eIF2α相互作用。接着作者利用酵母双杂实验验证了SPA1全长以及单独的激酶结构域都可以与eIF2α相互作用(图1a)。
为了研究它们在黑暗和光照条件下的相互作用活性,作者进行了Co-IP实验来进一步测试它们的相互作用。将eIF2α.1-GFP和eIF2α.2-GFP转基因拟南芥幼苗的总蛋白提取后,与通过串联亲和纯化(TAP)制备的cMyc-SPA1转基因幼苗总蛋白进行混合,混合物用GFP-Trap 孵育进行Co-IP。结果表明,光处理的黄化幼苗中检测到eIF2α同源物(eIF2α.1、eIF2α.2)与SPA1的相互作用(图1b),而暗处理实验组中未观察到互作,表明光促进了eIF2α同源物与SPA1的相互作用,并利用Co-IP、BiFC实验进一步证明eIF2α同源物与SPA1在细胞质中相互作用(图1c,d)。
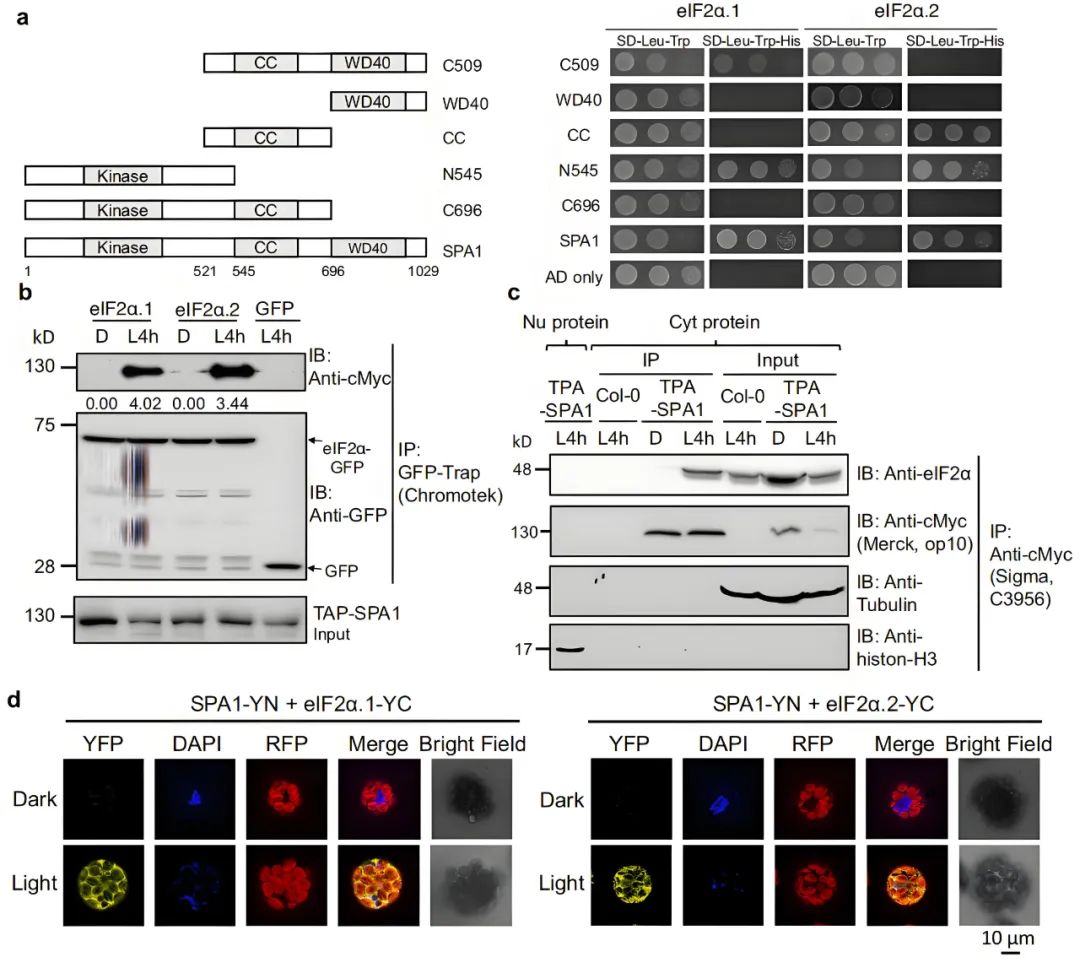
图1 SPA1通过其激酶结构域以光依赖的方式与细胞质中的eIF2α相互作用(Chang et al., 2024)。(a)SPA1的全长和各种结构域以及以这些结构对应的序列分别构建AD载体分别与eIF2α的两个同源物eIF2α.1、eIF2α.2进行酵母双杂实验;(b)Co-IP实验表明,eIF2α的两个同源物在光照下与SPA1相互作用;(c)Co-IP实验表明,光处理后细胞质TAP-SPA1与天然形式的eIF2α相互作用;(d)BiFC分析显示SPA1在光照条件下与eIF2α同源物相互作用。
SPA1直接磷酸化eIF2α的C端,但不磷酸化eIF2α的N端Ser56
eIF2α N端丝氨酸磷酸化位点在真核生物中高度保守。在确认SPA1与eIF2α的相互作用后,作者检测了SPA1是否能够磷酸化eIF2α的N端Ser56位点。为此,作者利用体外激酶测定实验验证了SPA1作为一种蛋白激酶,直接磷酸化eIF2α的C端结构域,而不是保守的N端丝氨酸磷酸化位点(Ser56)。这表明Ser56不是SPA1在拟南芥eIF2α中的主要磷酸化位点。
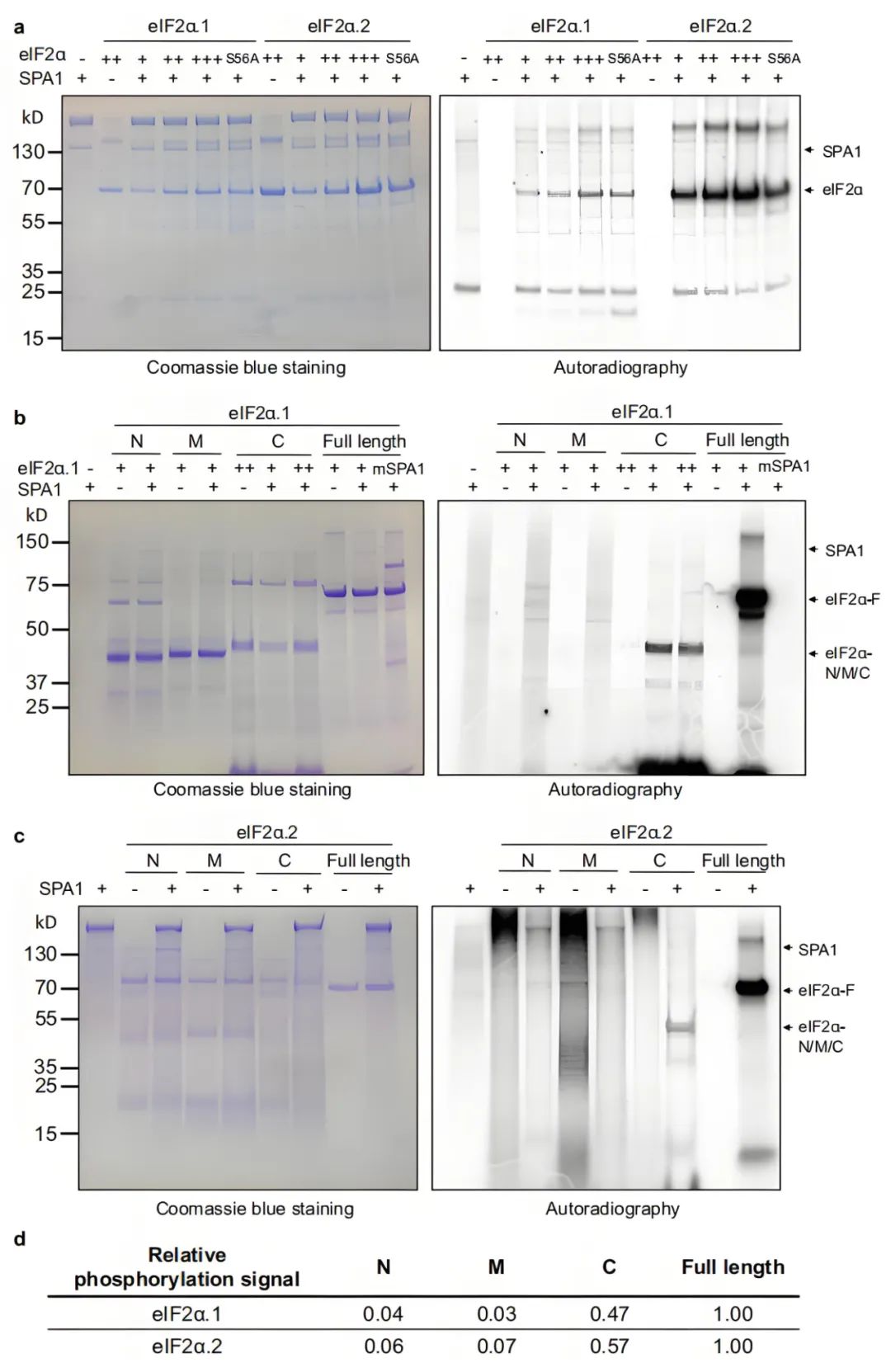
图2 SPA1在体外直接磷酸化eIF2α的C端结构域,但不磷酸化Ser56(Chang et al., 2024)。(a)体外激酶测定显示从毕赤酵母中纯化的SPA1蛋白可磷酸化eIF2α。保守的氨基酸突变Ser56(S56A)没有降低eIF2α的磷酸化信号;(b、c)体外激酶活性实验显示,从毕赤酵母中纯化的SPA1蛋白可分别磷酸化C端eIF2α.1和eIF2α.2,SPA1激酶结构域中保守氨基酸的突变(mSPA1)显著降低了SPA1对eIF2α的磷酸化活性;(d) 表格显示放射自显影信号的相对磷酸化强度。(注:图中右侧为放射自显影信号,左侧为考马斯亮蓝染色胶图显示各蛋白表达水平;图中N、M、C分别表示eIF2α的N端、中间及C端结构域。)
eIF2α.2的C端结构域磷酸化可提升翻译效率并促进光形态建成
为研究eIF2α.2 C端磷酸化的功能,作者在Col-0背景下构建了过表达野生型(WT)、磷酸化缺失型(8A)和磷酸化模拟型(8D)的eIF2α.2转基因植株。通过多聚核糖体图谱分析,作者检测了经4小时白光处理或未处理的四天龄黄化苗(eIF2α.2-WT、eIF2α.2-8A、eIF2α.2-8D转基因株系)的翻译效率(图3a)。结果显示:eIF2α.2-WT过表达植株与Col-0具有相似的模式,光照后多聚核糖体(PL)组分显著增加;而eIF2α.2-8A过表达植株光照后PL峰仍显著低于WT;相反,eIF2α.2-8D过表达株系的PL峰不仅高于WT,光照后增幅更为显著。与核糖体图谱数据一致,通过分离NP(非多聚核糖体)和PL RNA的定量分析显示:磷酸化缺失型eIF2α.2-8A翻译效率显著降低,而磷酸化模拟型8D则表现出更高的翻译效率(图3b)。
为验证spaQ突变体中翻译抑制源于eIF2α C端体内磷酸化缺陷,作者利用AGROBEST转化技术瞬时表达eIF2α.2-WT、eIF2α.2-8A及eIF2α.2-8D,并分析多核糖体图谱,探究磷酸化模拟型eIF2α.2能否挽救spaQ突变体在光下的翻译抑制。如图3c所示,过表达eIF2α.2-WT或eIF2α.2-8A的植株与spaQ突变体类似,光诱导无法显著提升翻译效率;而过表达eIF2α.2-8D的植株在暗/光处理下均表现出高翻译效率。NP与PL RNA的定量结果亦与多核糖体图谱模式一致(图3d)。免疫印迹证实spaQ突变体中瞬时表达的eIF2α.2各变异体表达量均等。以上数据表明,SPAs介导的eIF2α.2 C端结构域磷酸化在暗-光转换过程中促进翻译效率。
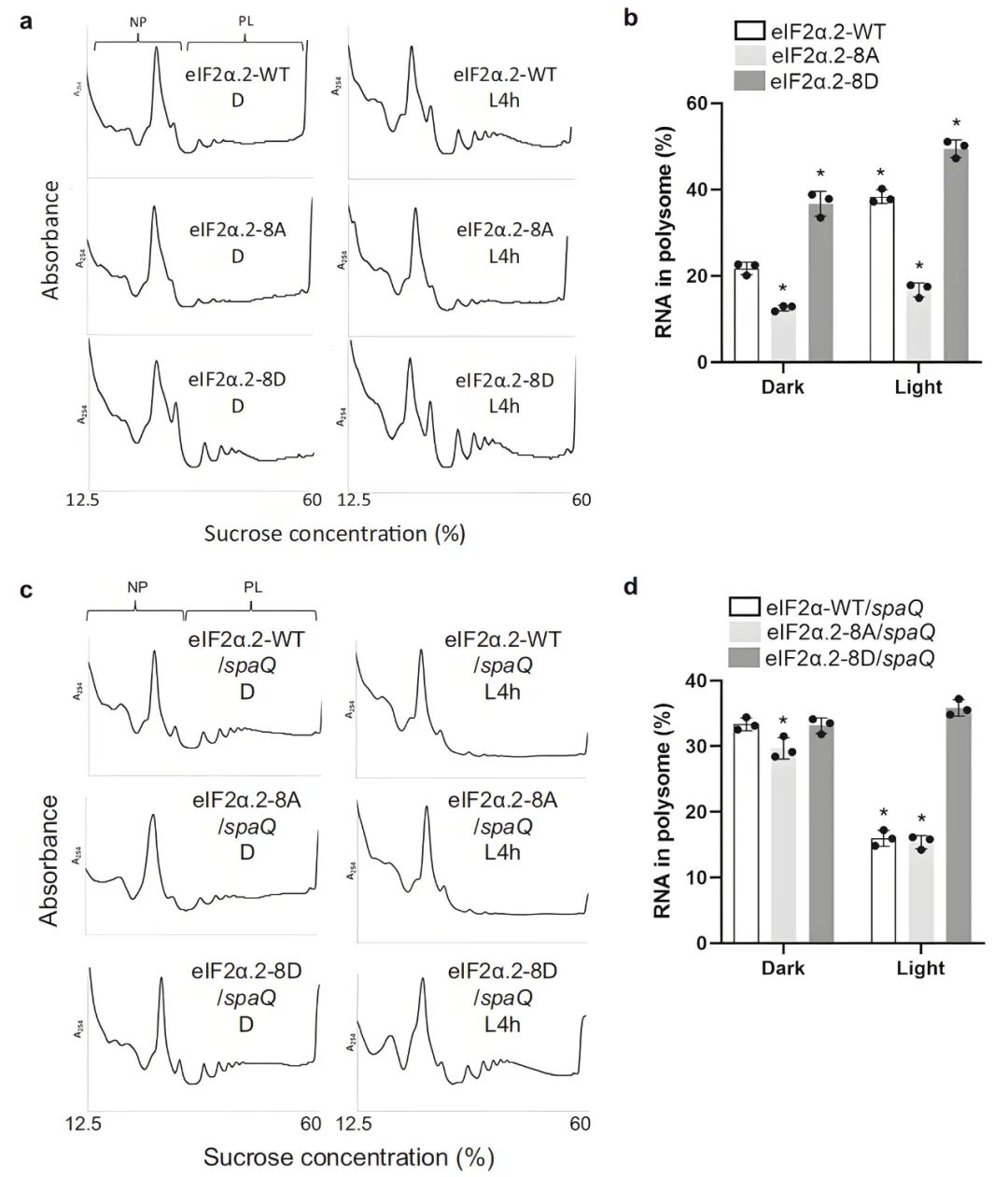
图3 SPAs介导的eIF2α C端磷酸化促进翻译(Chang et al., 2024)。多核糖体图谱分析显示,在Col-0(a)和spaQ(c)遗传背景下,eIF2α.2-WT、eIF2α.2-8A及eIF2α.2-8D转基因植株的核糖体RNA分布模式存在差异;图(b、d)为柱状图,展示了Col-0(a)和spaQ(c)背景下eIF2α.2-WT、eIF2α.2-8A及eIF2α.2-8D转基因植株中多聚核糖体RNA占总RNA的百分比。
02
m6A修饰抑制翻译
6-甲基腺苷(N6-Methyladenosine,m6A)是真核生物mRNA上含量最丰富的内部修饰,该修饰影响mRNA的稳定性、前体RNA的剪接加工、多腺苷酸化、mRNA的运输和翻译起始等多种RNA代谢过程 。近年来的多项研究证实,m6A修饰在植物生长发育、生物和非生物胁迫响应以及作物性状改良等方面发挥着重要作用。特别是在植物遭受外界逆境胁迫时,m6A修饰的动态可逆变化能够快速调控基因表达,从而赋予植物极强的环境适应性。然而,植物如何利用这种化学修饰在逆境条件下迅速调整其生长的机理至今尚不清楚。
2024年3月,新加坡国立大学俞皓院士团队与申莉莎研究员课题组合作在Nature Plants杂志上发表了一篇题为“N6-methyladenosine-mediated feedback regulation of abscisic acid perception via phase-separated ECT8 condensates in Arabidopsis”的研究论文,本研究发现m6A修饰及其识别蛋白ECT8可以共同作为ABA信号负反馈调控的关键因素。ECT8通过液-液相分离形成应激颗粒(Stress Granules, SGs),介导m6A修饰隔离ABA受体mRNA,进而负向调节ABA感知,由此揭示m6A修饰反馈调控植物激素ABA信号感知的新机制,这个过程也涉及翻译调控,具体是如何调控的,下面是具体的研究。
PYL7 RNA在ABA作用下被ECT8招募到SGs中
前期研究表明,ECT8会招募m6A修饰的mRNA来响应ABA形成SGs,并且在ect8-1突变体SGs中呈现低甲基化和表达下调的mRNA包括PYL7(该基因编码一种能高亲和力结合ABA并增强抗旱能力的ABA受体)。PYL7转录本的3'非翻译区含有一个高可信度的m6A修饰位点(ATTTm6ACGCA)(图4a)。通过跨越该位点的引物进行m6A免疫沉淀-qPCR(m6A-IP-qPCR)实验,证实在ABA处理条件下,与野生型相比,ect8-1突变体中富集于SGs的RNA(而非总RNA)内PYL7转录本的m6A修饰水平显著降低(图4b)。与纳米孔直接RNA测序结果一致,ABA处理后ect8-1突变体SGs富集的mRNA中PYL7转录水平较野生型幼苗显著降低,尽管其在ect8-1突变体总细胞mRNA中的水平仅轻微下降(图4c)。这些发现表明,ECT8通过促进m6A修饰的PYL7转录本在ABA诱导的SGs中积累,从而调控其表达水平。值得注意的是,在ect8-1 gECT8-GFP植株中,PYL7转录本的低m6A修饰水平及其在ect8-1 SGs中的表达量均下降恢复至野生型水平,而在ect8-1 gECT8ΔIDR-GFP(ect8-1背景下表达不含IDR区域的gECT8-GFP的转基因植株)或ect8-1 gmECT8-GFP植株中未能恢复(ect8-1背景下表达YTH结构域两个保守的色氨酸残基(Trp343和Trp404)突变为丙氨酸残基,生成了一个突变版本的ECT8(以下称为mECT8)的gECT8-GFP的转基因植株,其中YTH结构域的保守色氨酸残基对于结合m6A至关重要)(图4b,d)。这表明ECT8的相分离能力和m6A结合能力对其在ABA响应过程中调控PYL7在SGs中的功能至关重要。
为验证ECT8是否在体内结合PYL7转录本,作者利用ect8-2 gECT8-FLAG植株进行了RNA免疫沉淀结合qPCR(RIP-qPCR)实验。结果显示,无论是否施加ABA处理,ECT8均与PYL7转录本存在结合,且ABA处理后这种结合显著增强。为探究ABA处理下SGs中ECT8与PYL7转录本的相互作用,作者从ect8-1 gECT8-GFP和ect8-1 gECT8-GFP 35S::Rbp47b-RFP植株中纯化了SGs组分,发现ABA处理后ECT8-GFP在SGs中高表达并与Rbp47b(RNA结合蛋白47b)共定位。RIP-qPCR进一步显示,SGs组分中ECT8-GFP结合的PYL7转录本数量显著多于上清组分(图4e)。此外,通过针对PYL7转录本的单分子RNA荧光原位杂交(smFISH)实验发现,在模拟对照条件下,ect8-1 gECT8-GFP根尖细胞中的PYL7转录本呈弥散分布,而在ABA处理下则与ECT8-GFP明显共定位于SGs中(图4f)。值得注意的是,在ABA处理后,其他SGs组分缺陷突变体富集的SGs中PYL7的mRNA水平未发生显著变化,表明PYL7向SGs的募集特异性依赖于ECT8。综上,这些结果提示ECT8通过招募m6A修饰的PYL7转录本进入SGs以响应ABA信号。
PYL7 mRNA在SGs中的隔离限制了PYL7蛋白的水平
鉴于应激条件下mRNA在SGs中的滞留与翻译调控密切相关,作者进一步评估ECT8通过将m6A修饰的PYL7转录本招募至SGs是否会影响ABA响应中PYL7蛋白的水平。为此,作者在野生型背景下构建了gPYL7-GFP转基因植株,将该植株与ect8-1突变体杂交后,比较野生型与ect8-1背景下的PYL7-GFP蛋白水平。结果显示,模拟对照条件下两种基因型的PYL7-GFP水平无显著差异,而ABA处理后ect8-1植株中的PYL7-GFP蛋白水平显著高于野生型(图4g)。
综合上述结果可知,ECT8通过将m6A修饰的PYL7转录本募集至SGs中,限制PYL7蛋白的积累水平,从而实现对ABA信号通路的负反馈调控。
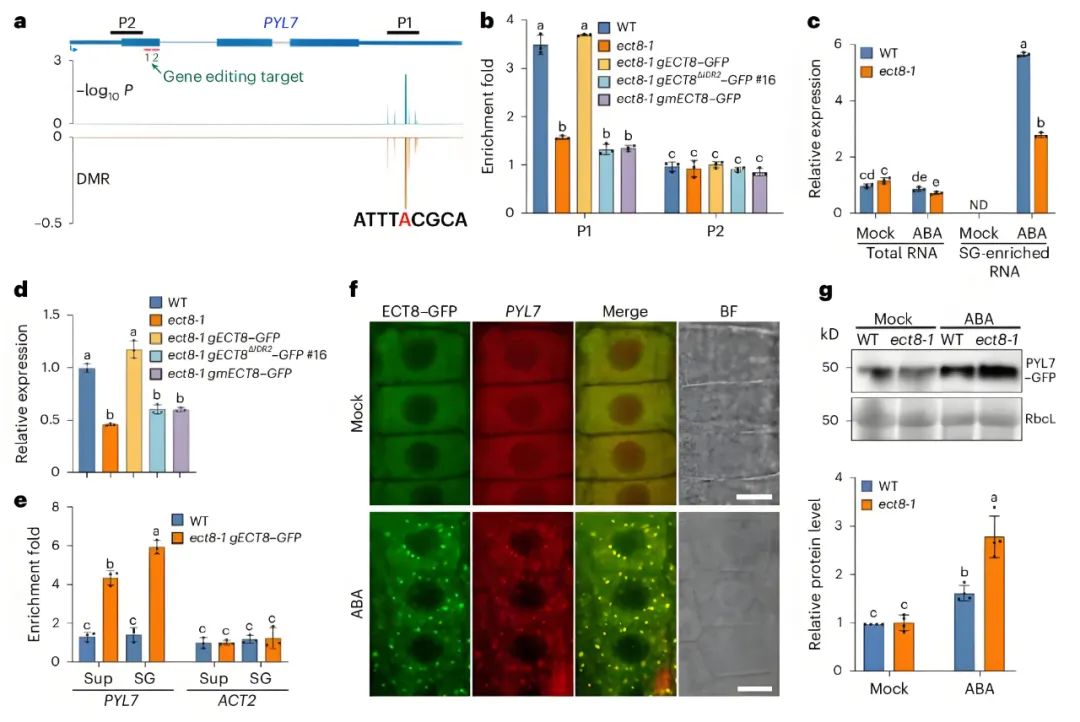
图4 ECT8的相分离作用将PYL7 RNA隔离在SGs中,进而影响PYL7蛋白在ABA响应中的积累水平(Wu et al., 2024)。(a)纳米孔直接RNA测序(DRS)鉴定PYL7转录本中高置信度的m6A修饰位点;(b)经50μM ABA处理6小时后,不同植株SG富集的PYL7转录本中m6A修饰水平的m6A免疫沉淀-qPCR(m6A-IP–qPCR)分析;(c,d)qPCR分析模拟处理和ABA处理后不同RNA组分中PYL7的转录水平(c),以及ABA处理下SG富集RNA中PYL7的转录水平(d);(e)RNA免疫沉淀(RIP)实验显示ABA处理下ECT8与上清(sup)及SG组分中PYL7转录本的结合水平;(f)smFISH显示ECT8–GFP与PYL7转录本在应激颗粒中的共定位;(g)WT和ect8-1背景中gPYL7–GFP报告植株的PYL7–GFP蛋白水平分析。
翻译后的蛋白被快速降解
真核生物中的蛋白降解系统主要分为泛素蛋白酶体途径和液泡介导的降解途径(自噬和内膜运输系统)两大类,它们不仅调控蛋白质的半衰期、氨基酸的循环利用,而且调控蛋白质的活性等特性,从而改变或微调植物生长、发育和对环境信号的响应过程。因此,正常的蛋白质降解系统是植物茁壮成长和正常繁殖的必要条件。下面我们一起去看看这两类蛋白降解导致蛋白的表达量与对应的mRNA的量不成线性相关的文献案例。
01
乙酰化介导的蛋白泛素化途径降解
组蛋白去乙酰化酶(HDACS)在植物应对非生物胁迫中发挥重要作用,但OsHDAC1在盐胁迫响应中的具体机制尚不清楚。2025年4月,武汉大学李立家课题组在Plant Physiology杂志上发表了一篇题为“OsHDAC1 deacetylates the aldehyde dehydrogenase OsALDH2B1, repressing OsGR3 and decreasing salt tolerance in rice”的研究论文,本研究揭示了OsHDAC1通过去乙酰化代谢酶OsALDH2B1,抑制其稳定性及下游基因OsGR3的表达,从而负调控水稻的盐胁迫耐受性。
文中为探究OsHDAC1介导的去乙酰化作用对OsALDH2B1稳定性的影响,作者首先检测了OsHDAC1过表达(OsHDAC1-OE)和RNA干扰(OsHDAC1-Ri)植株中OsALDH2B1的mRNA和蛋白水平。免疫印迹分析显示:与对照植株日本晴(NIP)相比,OsHDAC1-OE植株中OsALDH2B1蛋白丰度显著降低,而OsHDAC1-Ri植株中该蛋白则呈现积累趋势,但两组植株的mRNA水平均未发生明显变化。通过无细胞降解实验发现,OsHDAC1-OE植株的粗提液可加速OsALDH2B1-His融合蛋白的降解,而OsHDAC1-Ri植株的粗提液则对该蛋白具有稳定作用。进一步研究表明该降解过程具有蛋白酶体依赖性,因为26S蛋白酶体抑制剂MG132能够完全阻断这一降解过程(图5A,B)。
为验证OsHDAC1是否参与植物体内源OsALDH2B1的降解过程,作者采用新生蛋白质合成抑制剂环己酰亚胺(Cycloheximide,CHX)处理植株。结果显示:与体外实验结果一致,CHX处理后的OsHDAC1-OE植株中OsALDH2B1降解速率显著加快,而OsHDAC1-Ri植株中该蛋白降解则相对延缓(图5C,D)。值得关注的是,在野生型对照植株(NIP)中使用组蛋白去乙酰化酶抑制剂曲古抑菌素A(TSA)处理后,OsALDH2B1的降解过程明显受阻,这一现象进一步证实了去乙酰化修饰与蛋白质稳定性之间的功能关联。
为探究OsHDAC1介导的OsALDH2B1蛋白K311和K531位点(通过前面的实验与分析得出,这里省略了得出的过程)去乙酰化修饰对其稳定性的影响,作者构建了两种突变体蛋白:OsALDH2B1-KQ(将K311和K531突变为谷氨酰胺Q以模拟乙酰化状态)和OsALDH2B1-KR(突变为精氨酸R以模拟去乙酰化状态)。通过无细胞降解实验发现,模拟乙酰化状态的OsALDH2B1-KQ-His蛋白比模拟去乙酰化状态的OsALDH2B1-KR-His具有更强的稳定性(图5E,F)。上述结果表明,OsHDAC1很可能通过调控OsALDH2B1蛋白K311和K531这两个特定位点赖氨酸残基的去乙酰化修饰,进而影响该蛋白的稳定性。
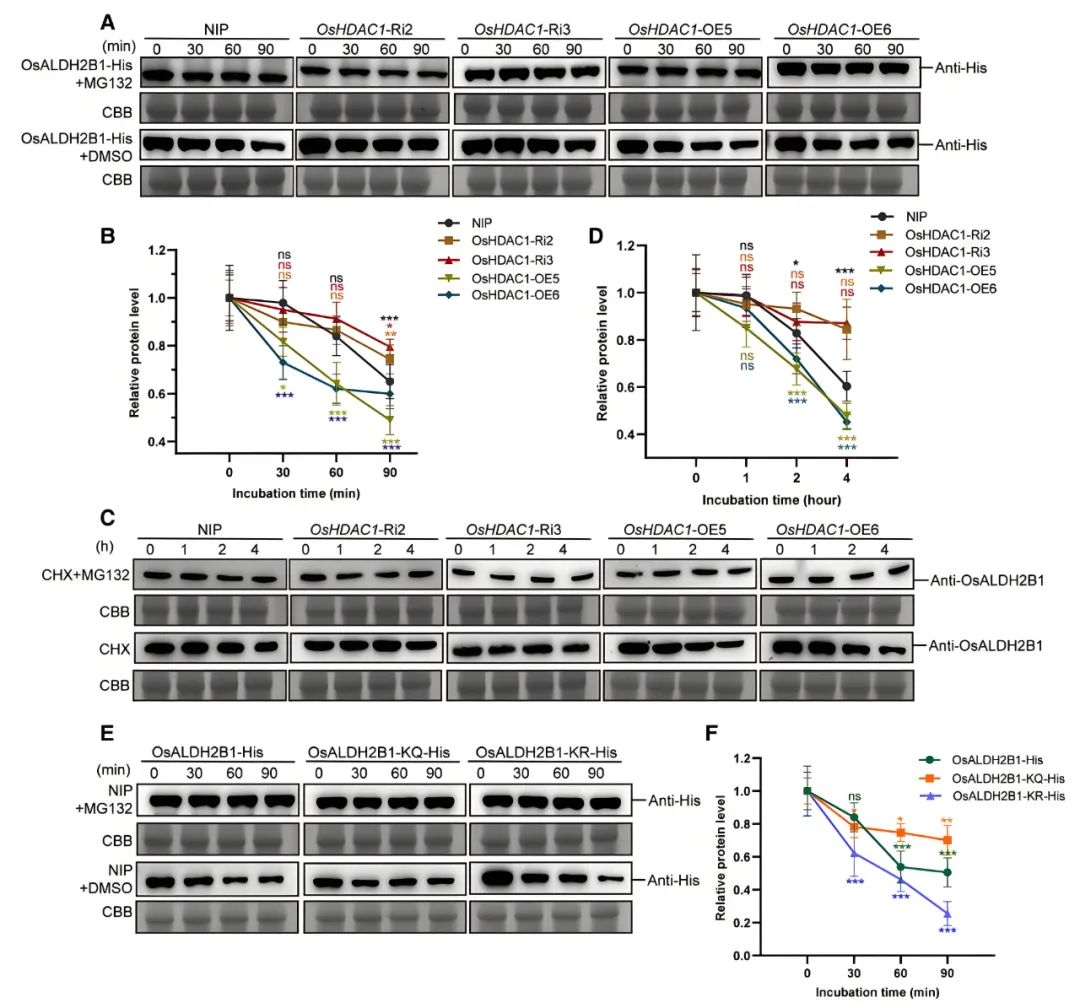
图5 OsHDAC1降低OsALDH2B1蛋白稳定性(Wu et al., 2025)。(A)OsHDAC1存在条件下的OsALDH2B1无细胞降解实验;(B)A图的定量分析;(C)OsHDAC1转基因植株中OsALDH2B1的降解分析;(D)C图的定量分析;(E)NIP植株提取物存在条件下OsALDH2B1-His及其突变体的无细胞降解实验;(F)E图的定量分析。
02
自噬降解
2023年6月,华盛顿大学生物学系Richard D. Vierstra课题组在Plant Physiology杂志上发表了一篇题为“Autophagy during maize endosperm development dampens oxidative stress and promotes mitochondrial clearance”的研究论文,这篇文章中作者为了研究自噬对胚乳蛋白质组的影响,通过鸟枪法LC-MS/MS分析了玉米胚乳的蛋白质,发现自噬缺失对蛋白质组的影响远大于转录组。在6 DAP和18 DAP时,突变体中分别有13.4%和29.1%的蛋白质丰度发生显著变化,尤其是18 DAP时蛋白质组差异更为明显。GO分析显示,突变体中的蛋白质富集于核糖体、线粒体和其他代谢功能相关的途径。部分蛋白质水平增加但mRNA未发生相应变化,表明这些蛋白可能是自噬底物或受翻译效率影响(这里就仅作简单介绍,感兴趣的小伙伴可以自行下载文献阅读噢)。
其他
01
mRNA水平稳定蛋白周期性振荡
PIF3 mRNA水平稳定
在短日照(8小时光照+16小时黑暗)条件下,PIF3的mRNA水平在24小时内保持稳定(图6a),不受昼夜节律调控。与之对比,PIF4和PIF5的mRNA水平受生物钟调控,呈现明显的昼夜振荡(图6a)。
PIF3蛋白周期性振荡
PIF3蛋白丰度在黑暗期逐步积累,并在夜晚结束时(即黎明前)达到峰值(图6b);光照后PIF3蛋白迅速被光敏色素(phyA和phyB)介导的降解机制清除(图6b,d);这种周期性变化由phyB主导:在黑暗初期,phyB的活性形式(Pfr)延缓PIF3的再积累,而phyB缺失突变体中PIF3蛋白积累更快且水平更高(图6e)。

图6 短日照条件下PIF3蛋白的积累分析(Soy et al., 2012)。(a) PIF3、PIF4、PIF5基因表达量分析;(b) 野生型(WT)幼苗蛋白提取物的PIF3免疫印迹;(c) YFP-PIF3过表达植株幼苗蛋白提取物的免疫印迹;(d) 野生型(WT)、phyA-211、phyB-9及phyA phyB双突变体幼苗蛋白提取物的免疫印迹;(e) 野生型(WT)与phyB-9突变体幼苗蛋白提取物的免疫印迹。
导致mRNA的量与蛋白表达量不成线性相关的原因伯远生物(https://plant.biorun.com)就先给大家介绍到这里了,其实要想把这个内容写清楚涉及到的方面非常多,伯远生物(https://plant.biorun.com)没办法一一展开。只能将一些比较有代表性的文献案例介绍给大家,希望对大家有所启发,同时也希望能帮助大家理解一些平时科研实验过程中遇到的一些不太好解释的情况,比如过表达材料分别检测转录水平与蛋白水平发现转录水平过表达了而蛋白水平没有过表达,你就可以从以上这些原因中去进行分析!
References:
Chang H H, Huang L C, Browning K S, et al. The phosphorylation of carboxyl-terminal eIF2α by SPA kinases contributes to enhanced translation efficiency during photomorphogenesis[J]. Nature Communications, 2024, 15(1): 3467.
Lee S, Paik I, Huq E. SPAs promote thermomorphogenesis by regulating the phyB-PIF4 module in Arabidopsis[J]. Development, 2020, 147(19): dev189233.
Paik I, Chen F, Ngoc Pham V, et al. A phyB-PIF1-SPA1 kinase regulatory complex promotes photomorphogenesis in Arabidopsis[J]. Nature Communications, 2019, 10(1): 4216.
Soy J, Leivar P, González‐Schain N, et al. Phytochrome‐imposed oscillations in PIF3 protein abundance regulate hypocotyl growth under diurnal light/dark conditions in Arabidopsis[J]. The Plant Journal, 2012, 71(3): 390-401.
Wang W, Paik I, Kim J, et al. Direct phosphorylation of HY5 by SPA kinases to regulate photomorphogenesis in Arabidopsis[J]. New Phytologist, 2021, 230(6): 2311-2326.
Wu X, Su T, Zhang S, et al. N6-methyladenosine-mediated feedback regulation of abscisic acid perception via phase-separated ECT8 condensates in Arabidopsis[J]. Nature Plants, 2024, 10(3): 469-482.
Wu Y, Hou J, Xiao H, et al. OsHDAC1 deacetylates the aldehyde dehydrogenase OsALDH2B1, repressing OsGR3 and decreasing salt tolerance in rice[J]. Plant physiology, 2025, 198(1): kiaf149.
