【读论文】质心重分配显微镜实现活样本超分辨成像
文章来源:bioRxiv preprint doi: https://doi.org/10.1101/2025.08.03.668310 ; this version posted August 3, 2025.
本文档仅为个人学习使用,前面有中英对照,后面看累了,都是AI翻译。
李川 ¹³*、黎泉 ²、朱利安・O・木村⁴⁵、赵冰莹 ¹³、李云哲⁶、赵健⁴⁵、托马斯・比法诺 ³、布兰登・维斯鲍德⁴⁵、约翰・T・吴 ²、杰罗姆・默茨 ²³*
(¹ 美国马萨诸塞州波士顿市波士顿大学电气与计算机工程系,邮编 02215;² 美国马萨诸塞州波士顿市波士顿大学生物医学工程系,邮编 02215;³ 美国马萨诸塞州波士顿市波士顿大学光子学中心,邮编 02215;⁴美国马萨诸塞州剑桥市麻省理工学院生物学系,邮编 02139;⁵美国马萨诸塞州剑桥市麻省理工学院皮考尔学习与记忆研究所,邮编 02139;⁶美国加利福尼亚州伯克利市加州大学伯克利分校电气工程与计算机科学系,邮编 94720)
* 电子邮箱:chuanli1@bu.edu;jmertz@bu.edu
摘要
Superresolution imaging(超分辨成像) has become one of the most important recent advances in microscopy(显微镜技术) development. However, most superresolution methods are ill-adapted for live-sample imaging because they are unacceptably slow(速度过慢), susceptible to artifacts(易产生伪影), or require the use of specialized fluorophores(荧光团) and labeling protocols(流程、实验方案、通讯协议). We introduce a superresolution method called centroid reassignment microscopy (CRM质心重分配显微镜) that overcomes these limitations. CRM is a simple variation(改进版本) on confocal microscopy(共聚焦显微镜) wherein the single-element detector(单元素探测器) and small pinhole(针孔) are replaced by a centroid detector(质心探测器) and larger pinhole. Superresolution is obtained by reassigning the centroid location of the detected fluorescence as a function of the scanning excitation focus location(通过将探测到的荧光质心位置作为扫描激发焦点位置的函数进行重分配). Our method bears resemblance to(与……相似) the method of image scanning microscopy, which involves the use of an array detector, with the advantage that CRM provides improved resolution for the same number of detected photons(探测光子数量相同的情况下) while being simpler to implement(实施更简单). CRM is light-efficient(光效率高), fast (single frame), robust to defocus aberrations(离焦像差), and requires no changes whatsoever(?) in standard fluorescence imaging protocols, making it uniquely attractive for superresolution imaging of live, dynamic samples.
引言
高分辨率光学成像对于揭示活生物系统的动态结构(dynamic architecture of living biological systems)至关重要,例如线粒体分裂与融合(mitochondrial fission and fusion)¹²、轴突运输(axonal transport)³⁴、突触可塑性(synaptic plasticity)⁵⁶、细胞骨架重塑(cytoskeletal remodeling)⁷⁸等过程。捕捉这些动态事件需要的成像技术,不仅需突破衍射极限(diffraction limit)(<200 nm)以实现高空间分辨率,还需保证样本的长期存活(maintain long-term sample viability)⁹。尽管已有多种超分辨技术应用于活样本成像⁹,但它们均面临(these have been hindered by)显著挑战:
- 单分子定位显微镜Single molecule localization microscopy(SMLM) ¹⁰⁻¹⁷(如光激活定位显微镜 PALM、随机光学重建显微镜 STORM——Photoactivated Localization Microscopy (PALM) and STochastic Optical Reconstruction Microscopy (STORM))需使用专用的闪烁或光切换分子(specialized blinking or photoswitchable molecules),通常需采集数百至数千幅原始图像,且样本制备流程严苛;
- 受激发射损耗Stimulated-emission depletion(STED)显微镜 ¹⁸需复杂的仪器装置(instrumentation),且照明功率高(involving high illumination powers),兼容的荧光团种类有限(a limited range of fluorophore compatibility);
- 结构光照明显微镜Structured illumination microscopy(SIM) ¹⁹²⁰(基于频率复用)需精确估计照明图案,易受噪声和像差影响;
- 随机照明显微镜Random illumination microscopy(RIM) ²¹ 需采集数百幅原始图像,易产生运动伪影。
迄今为止,超分辨显微镜在活样本成像中的适用范围,仍远不及传统共聚焦显微镜。
事实上,传统共聚焦显微镜本身也可视为一种结构光照明显微镜(structured illumination approach) ²²,但其超分辨能力(superresolution capacity)有限。要从共聚焦显微镜获得最佳分辨率,需将针孔闭合至零尺寸,但这在实际操作中无法实现,因此需在分辨率与信号强度之间权衡(imposing a compromise between resolution and signal strength)。图像扫描显微镜image scanning microscopy(ISM)²²²³ 解决了这一权衡问题:其分辨率与针孔闭合的共聚焦显微镜基本相当,而光收集效率则与针孔打开时一致。ISM 用阵列探测器替代了共聚焦显微镜的单元素探测器,通过像素重分配实现超分辨。早期 ISM 采用计算重分配方式 ²²²³,成像速度受采集和计算时间限制,后来蔡司 AiryScan²⁴技术的出现提升了成像速度。随后研究发现,ISM 也可通过全光学方式实现 ²⁵²⁶,并可推广至多点点扫描 ²⁷²⁸。光学重分配技术的优势在于无需计算即可直接获得超分辨图像,但缺乏计算方法的通用性和灵活性(versatility and flexibility of computational approaches) —— 例如,无法实时补偿激发与发射点扩散函数(PSF)的差异(they cannot on the fly compensate for differences between excitation and emission PSFs),或局部像差(local aberrations)引起的 PSF 畸变等。
近年来,单光子雪崩二极管(SPAD)阵列探测器的出现重新激发了人们对计算型 ISM 的兴趣 ²⁹³⁰。这类探测器通常为 5×5 小型阵列 ³¹,响应速率可达吉赫兹(GHz),成像速度远快于传统相机成像,甚至可将 ISM 拓展至荧光寿命成像领域 ²⁹³⁰³²³³。然而,即便 5×5 的阵列规模,也需通过 25 个独立的高带宽、低噪声电子通道采集 25 路信号,导致 ISM 的电子系统变得复杂笨重(unwieldy)。
本文提出一种兼具超分辨成像能力与高光收集效率的替代方法。该方法的核心(crux)是用质心探测器替代 ISM 中的阵列探测器 —— 质心探测器在任意时刻仅输出探测器上的总入射强度及其二维质心位置。也就是说,与 ISM 常用的阵列探测器相比,质心探测器输出的数据量减少了近一个数量级(almost an order of magnitude reduced data compared to array detectors conventionally used for ISM)。这种名为质心重分配显微镜(CRM) 的技术,是传统共聚焦显微镜的简单改进版本,完全兼容传统(非闪烁)荧光团。CRM 结合了单分子定位超分辨技术的 “质心定位” 优势 ¹¹¹²,以及 ISM 的 “像素重分配” 优势。与 ISM 相比,CRM 的分辨率可突破闭孔共聚焦极限(本文实现了 100 nm 以下分辨率),且实施更简便、对探测器噪声更不敏感。此外,CRM 无需人工干预(intervention)即可自动校正局部像差及激发与发射 PSF 尺寸不匹配的问题,从而具备扩展景深extended depth of field(EDOF)成像的潜力。综上,如后文所示,CRM 作为一种专为活样本成像设计的超分辨技术,具有独特的吸引力和通用性。
成果
原理
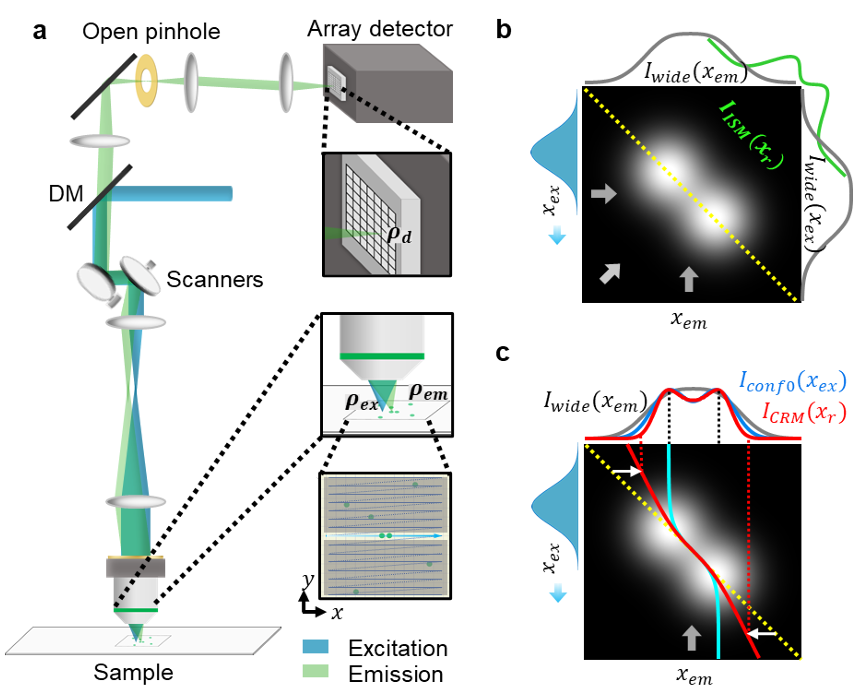
要理解 CRM 的工作机制,需先了解扫描荧光显微镜的通用原理(见图 1a)。传统扫描荧光显微镜中,单个激光束焦点在样本中进行二维扫描,形成以 ρₑₓ={xₑₓ, yₑₓ} 为中心的扫描激发光斑(a scanning excitation spot),其强度分布由激发 PSF 决定。产生的荧光通过相同的扫描机制进行消扫描后,被与样本平面共轭的阵列探测器探测(针孔(pinhole)可开可闭),探测器单元坐标记为 ρ_d。任意时刻,坐标 ρ_d 处的探测器单元探测到的荧光,来自样本平面中以 ρₑₘ = ρ_d - ρₑₓ为中心的区域,探测效率分布由发射 PSF 决定。
由于扫描过程的存在,ρₑₓ和 ρₑₘ均隐含时间依赖性,阵列探测器捕捉的强度分布可表示为 I (ρₑₓ, ρₑₘ),该分布为四维分布。要从四维分布构建二维图像,存在多种可选方式(为简化分析,假设激发与发射 PSF 相同,更一般的情况见补充说明):
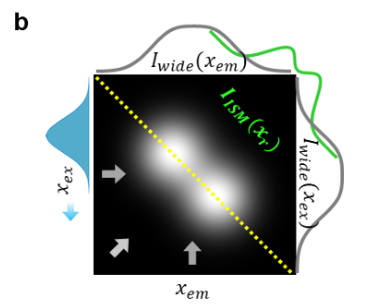
- 若针孔打开,将 I (ρₑₓ, ρₑₘ) 沿 ρₑₓ投影(即对所有 ρₑₓ值求和),可得到宽场图像 I_wide (ρₑₘ)(图 1b);
- 若沿 ρₑₘ投影(即对探测器像素求和),同样得到宽场图像 I_wide (ρₑₓ)(图 1b)。
根据互易性原理 ³⁴,这两种宽场图像完全等效,且均仅具备中等空间分辨率。
关闭针孔并采用共聚焦探测可提升分辨率:共聚焦图像 I_confo (ρₑₓ) 仅由四维分布的对角线元素 I (ρₑₓ, ρₑₘ=ρₑₓ)(黄色对角线)构建。然而,针孔引入的空间滤波会导致信号微弱、信噪比(SNR)差。实际操作中,需适当打开针孔,这会导致共聚焦图像 I_conf (ρₑₓ) 的分辨率下降。
ISM 可规避这一权衡:打开针孔,将 I (ρₑₓ, ρₑₘ) 沿反对角线方向投影。如图 1b 所示,I (ρₑₓ, ρₑₘ) 沿反对角线方向分布最稀疏,因此可更好地分辨两个点目标。重要的是,ISM 无需空间滤波,理论上无功率损失,可保持高 SNR(信噪比)。但如前所述,ISM 实施复杂,且分辨率提升幅度有限。
CRM 用质心探测器替代图 1a 中的阵列探测器,是另一种兼具高分辨率与高 SNR 的方法。如前所述,CRM 可视为 “质心定位” 与 “像素重分配” 的结合:
- 在 PALM/STORM 等传统定位超分辨技术中,荧光团的位置由其发射分布的质心确定 ¹¹¹²—— 换言之,发射质心是荧光团位置的最大似然估计(the emission centroid provides a maximum-likelihood estimate of the fluorophore location),但这仅在无额外先验信息时成立(例如大多数 PALM/STORM 实现中,激发强度在视场中均匀分布);
- 若激发为结构化分布,则可获得额外信息,此时发射质心不再一定是荧光团位置的最大似然估计。对于激发强度聚焦的情况(如 CRM),荧光团最可能位于发射质心与激发质心之间(当 PSF 对称时,位于中点)。因此,要使发射质心对应荧光团位置,需对其进行相应重分配。
这一重分配原理与 ISM 类似,区别在于 CRM 进行 “质心重分配”,而 ISM 进行 “单个像素重分配”。实验装置细节见 “方法” 部分,补充说明 1 证明:先进行质心测量再重分配,与先进行像素重分配再进行质心测量,效果完全等效。前者的优势在于仅需质心探测器,无需完整的阵列探测器。
当然,质心测量虽能定位单个荧光团,但仅凭自身无法分辨近距离的多个荧光团。例如,传统宽场显微镜成像中(如图 1b 中的灰色轨迹),
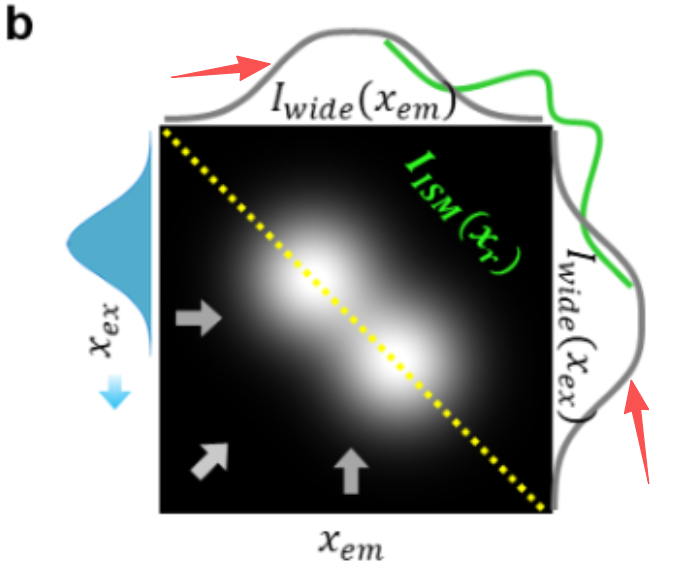
两个邻近荧光团的发射质心会位于两者中点,其空间分离程度不足以区分各自的 PSF。要实现区分,需额外维度提升分离度:PALM/STORM 通过 “时间” 维度(利用闪烁荧光团),而 CRM 同样利用 “时间” 维度,但通过光束扫描实现(无需闪烁分子)。由于扫描的存在,两个荧光团不仅出现在略微不同的空间位置,还会出现在略微不同的时间点,CRM 正是利用了这种时间维度上的稀疏性提升。
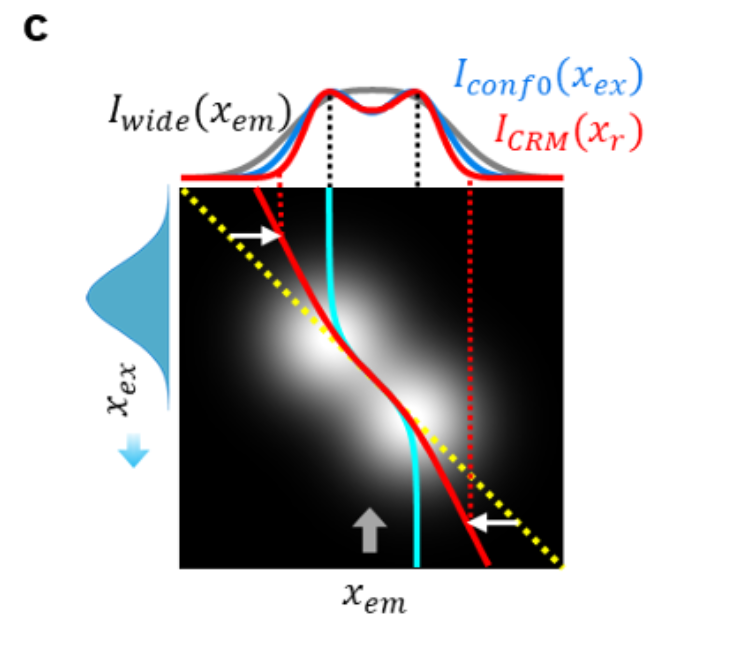
如图 1c 所示,两个邻近荧光团的质心位置 ρ̂ₑₘ(青色轨迹)不再固定于两者中点,而是随时间在两个荧光团之间移动,清晰显示出它们的分离。CRM 的具体操作是:将质心探测器测量的总功率重分配到 ρ̂ₑₘ与 ρₑₓ之间的某个位置,再将整个扫描过程(即所有 ρₑₓ值)中的重分配功率累积,最终得到 CRM 图像。
需注意,计算重分配位置 ρᵣ时,可对 ρ̂ₑₘ和 ρₑₓ赋予不同权重:
- 如补充说明 3 所述,将 ρᵣ重分配至 ρ̂ₑₘ与 ρₑₓ的大致中点(重分配因子 α≈1/2),可获得更平滑、保真度更高的图像,适用于荧光标记密集的场景;
- 将 ρᵣ重分配至更靠近 ρ̂ₑₘ的位置(α≈1),可获得更锐利的特征,适用于荧光标记稀疏的场景。
CRM 图像形成与重建
CRM 与传统共聚焦显微镜的硬件差异仅在于:CRM 使用大幅打开的针孔和质心探测器。质心探测器有多种类型,本文为实现足够带宽,采用简单的四象限探测器(QD,详见 “方法” 部分)。但四象限探测器本身无法直接输出质心位置,需引入与入射到 QD 上的光斑尺寸相关的缩放因子。该缩放因子可基于已知的光学放大率和分辨率先验估计,也可通过实验测量 —— 采用文献 35 提出、文献 29 后续使用的图像互相关策略。与以往不同,本文中缩放因子的测量采用 “局部测量” 而非 “全局测量”(详见 “方法” 部分),因此可在整个图像中调整缩放因子向量 S,以补偿局部像差等因素的影响。
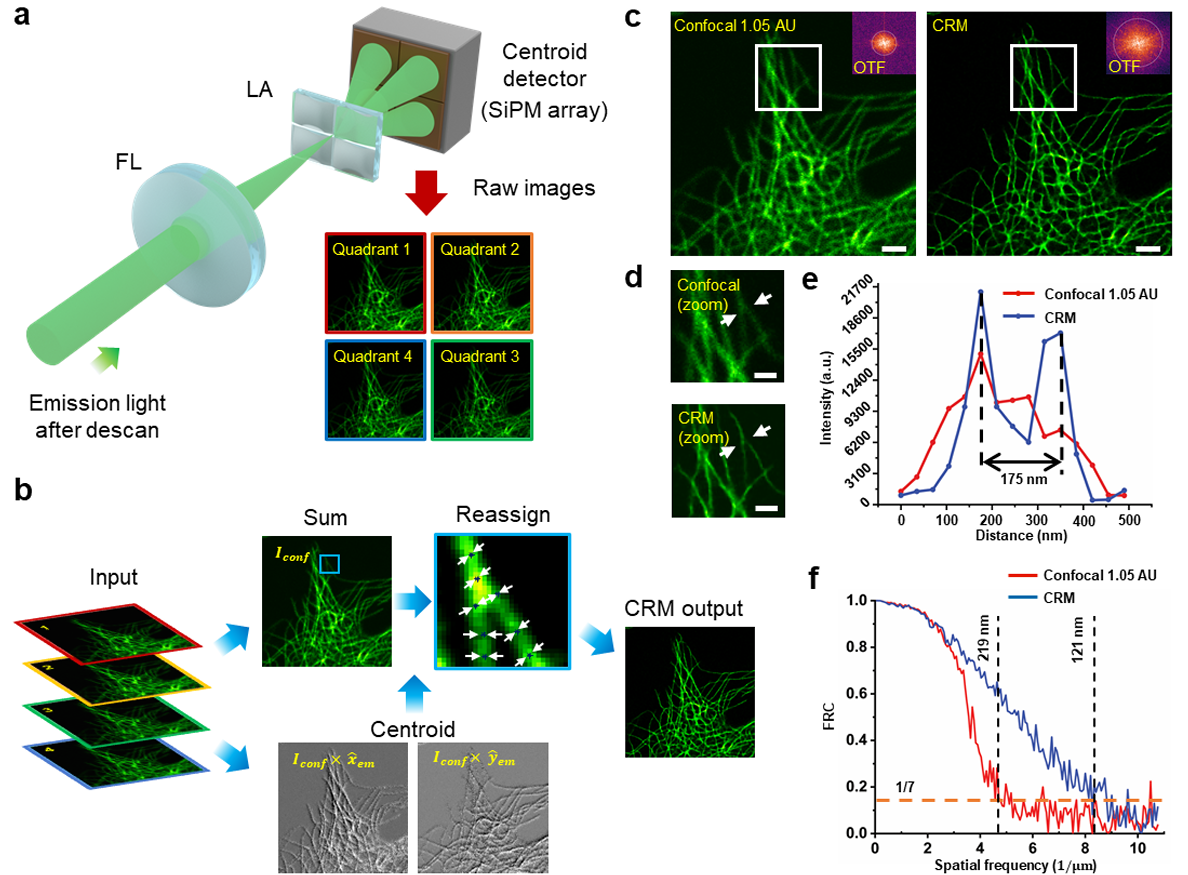
图 2 展示了以四象限探测器为质心探测器的 CRM 算法示意图(细节见 “方法”)。实验中,我们对固定牛肺动脉内皮细胞(BPAE)中抗 α- 微管蛋白标记的微管进行成像:
- 图 2c-e 对比了 CRM 与传统共聚焦显微镜(四象限求和)的分辨率提升效果,CRM 可更清晰地分辨间距约 175 nm 的两条微管;
- 傅里叶环相关(FRC)³⁶是评估显微镜分辨率(尤其适用于超分辨成像)的标准方法,基于 FRC 分析(图 2f),本例中 CRM 实现的分辨率为 121 nm(重分配因子 α=0.7)。
重分配因子对 CRM 的影响
重分配显微镜的空间分辨率取决于重分配因子 α。为验证这一点,我们将 CRM 与最先进的商用 ISM(蔡司 LSM980 Airyscan2,详见 “方法”)进行对比,对固定 BPAE 细胞进行双色序贯成像(图 3a:F - 肌动蛋白为绿色,线粒体为品红色)。为保证对比公平,设置相同的照明功率、像素尺寸和像素停留时间,通过 FRC 方法评估不同重分配因子对分辨率的影响。
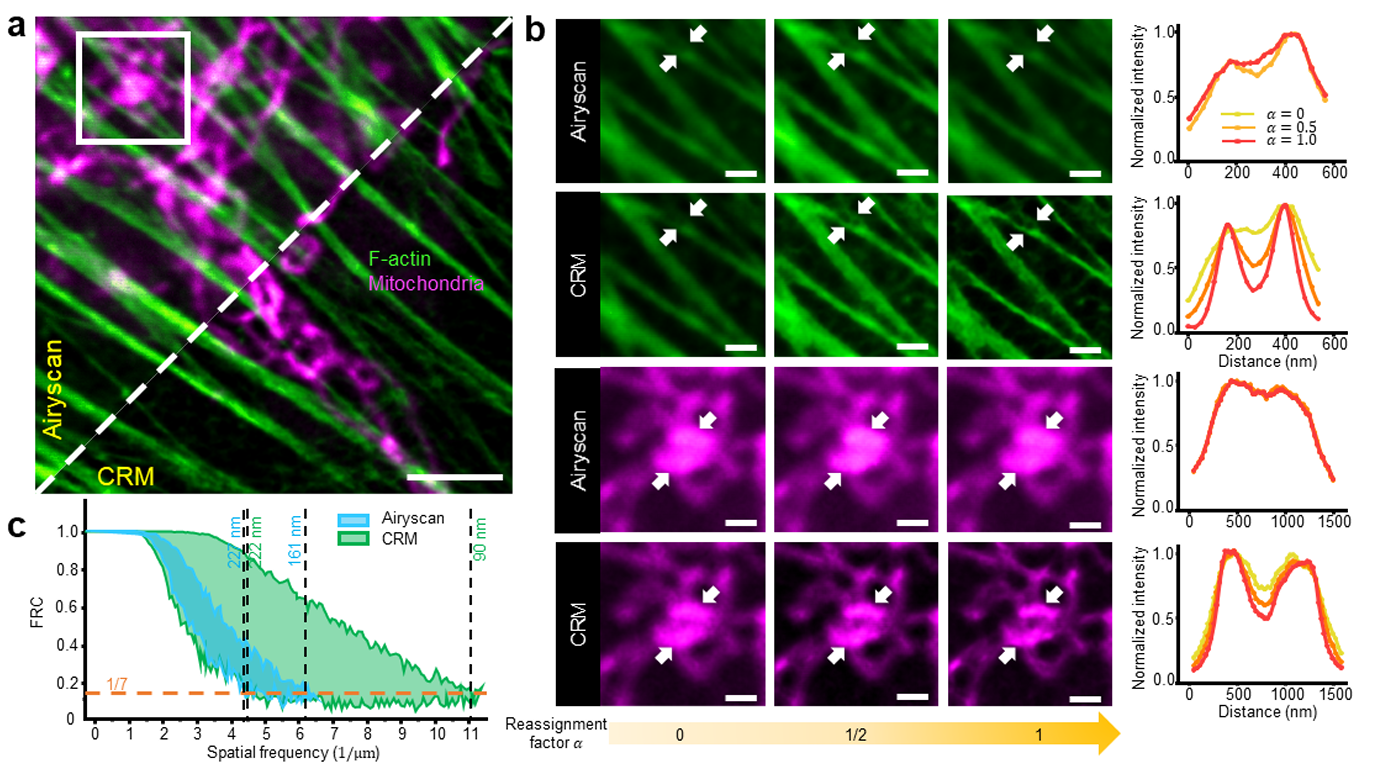
结果符合预期:
- 当 α=0 时,CRM 与 ISM 的分辨率相近,均接近传统共聚焦显微镜;
- ISM 在 α≈1/2 时获得最佳分辨率;
- 与之相反,CRM 的分辨率随 α 增大而持续提升,当 α→1 时,特征分离度显著改善(这与理论和模拟预期定性一致,见补充说明 3)。
需注意,Airyscan 中单个探测器单元的尺寸为 0.2 艾里单位(AU),这限制了 ISM 的整体分辨率,而 CRM 无此限制。基于 FRC 分析(图 3c),使用 1.42 数值孔径(NA)油浸物镜(奥林巴斯 UPlanXApo 60×/1.42 Oil)时,CRM 的分辨率可高达 90 nm。扩展数据图 1 中,通过对 100 nm 荧光微球成像进一步验证了这一结果:由峰位推断的两个邻近微球间距,不随 α 值变化而改变,表明 CRM 的重分配因子选择具有高度灵活性。
CRM 分辨率提升对噪声稳健
与 ISM 相比,CRM 的主要优势在于:在光子预算相同的情况下,光收集效率更高、分辨率提升更显著。图 4 概述了不同照明功率(即不同 SNR 水平)对图像分辨率的影响。需注意,从同一 Airyscan 原始数据中,可合成标准共聚焦图像(所有探测器像素求和)、小针孔共聚焦图像(仅中心探测器像素)和 ISM 图像(重分配探测器像素),并与 CRM 图像对比(照明功率、像素尺寸和像素停留时间均相同)。
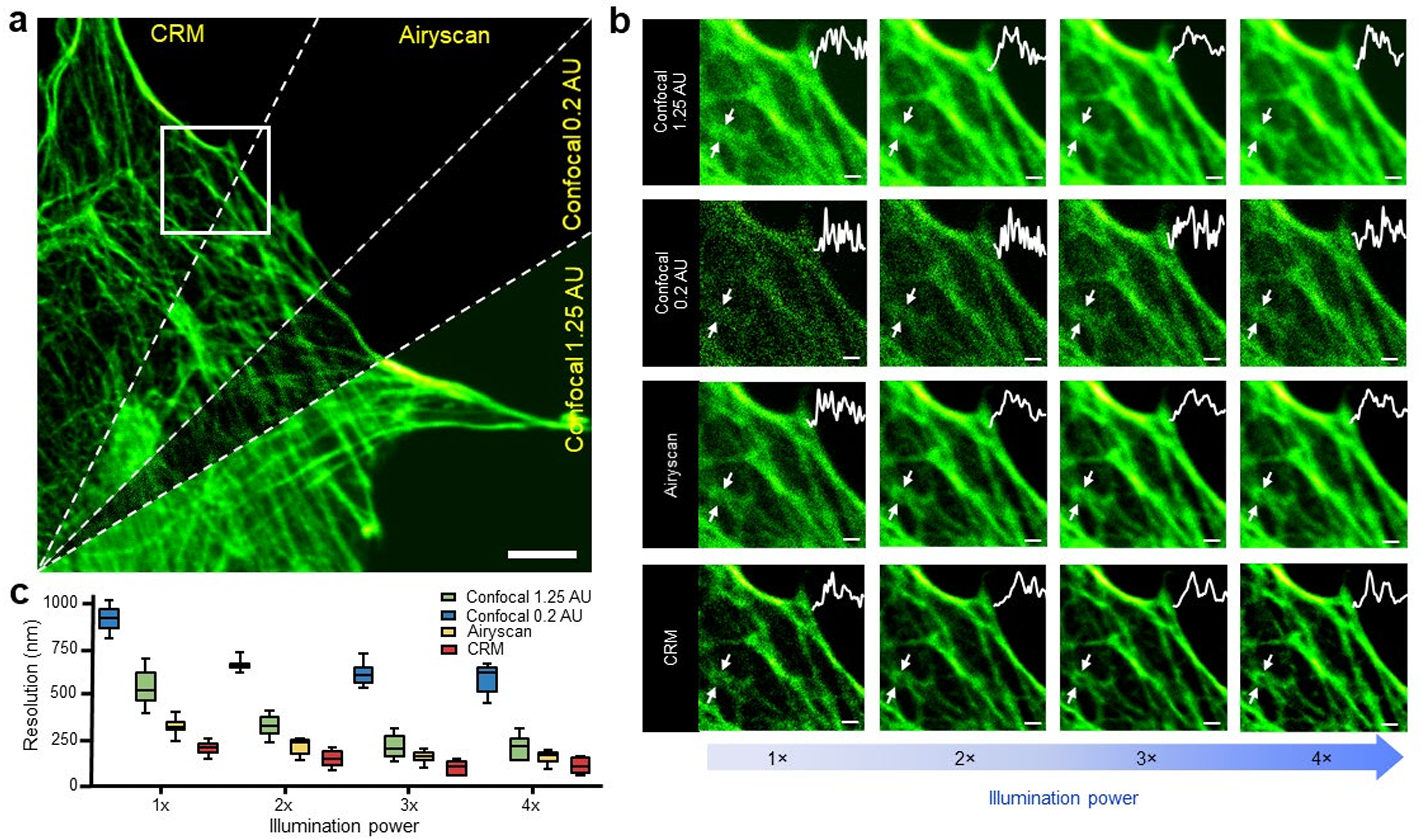
为减少背景、像差或信号水平对 FRC 分析的影响,我们对图 4a 中 8 个不同区域的 FRC 结果取平均值,结果再次表明 CRM 分辨率最高。FRC 方法的优势在于,它考虑了探测噪声(散粒噪声、电子噪声等)对分辨率的不利影响:在激发功率较低时,SNR 降低会更严重地损害图像质量(小针孔共聚焦尤为明显),而 CRM 的分辨率优势在此场景下更为突出。
上述结果均采用重分配因子 α=0.8 获得,该值在分辨率提升与图像保真度之间取得了平衡。补充图 8 通过对线对成像随探测光子数变化的模拟,进一步验证了 CRM 对噪声的稳健性:由于在相同光子预算下 CRM 分辨率优于 ISM,相同数量的探测光子会被压缩到更小区域,从而在线对分离度评估中持续提升 SNR。
需说明的是,该模拟仅包含散粒噪声;若同时计入探测器噪声,CRM 的性能优势会进一步凸显 —— 因其所需探测器单元数量更少,电子噪声更低。
CRM 的活样本成像应用
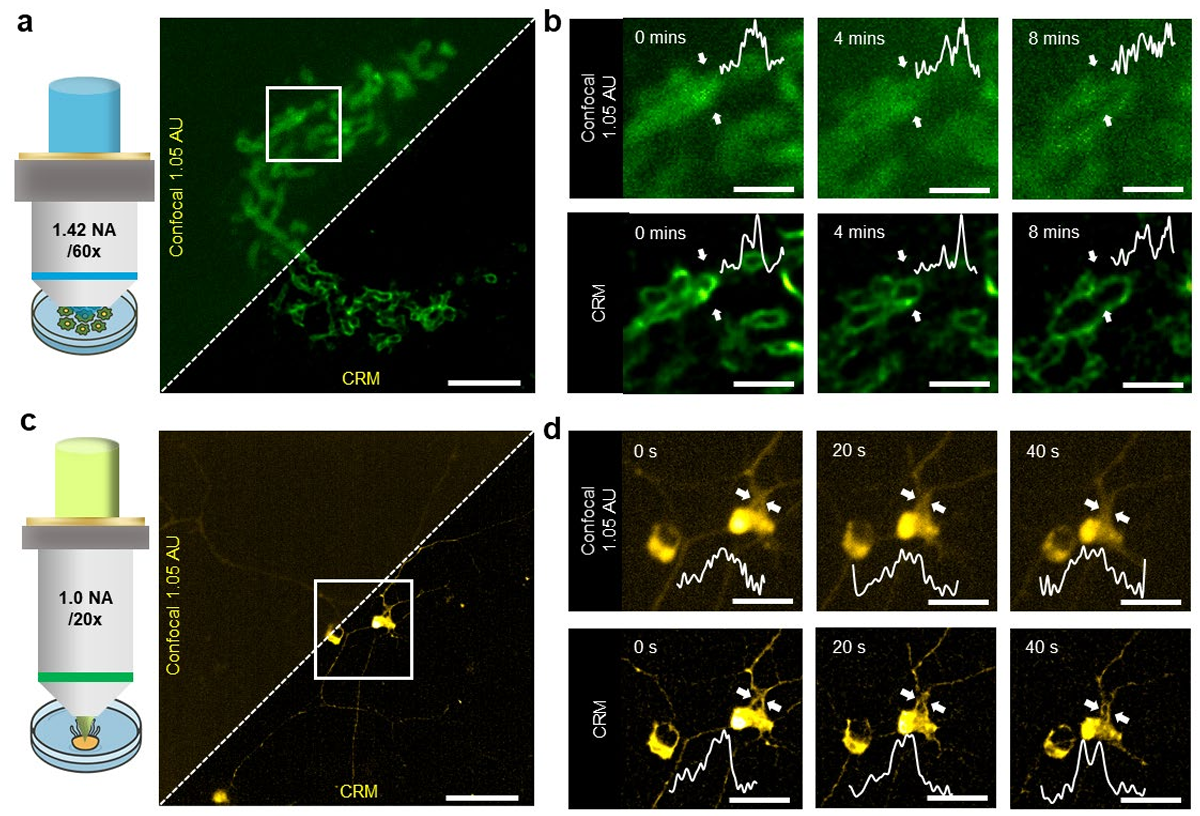
CRM 具有极高的光效率,非常适合活样本的长期成像。图 5 展示了 CRM 在活样本动态过程成像中的应用案例,包括 U2OS 骨肉瘤细胞的线粒体分裂与融合,以及水母神经元的运动。
在 U2OS 细胞实验中(图 5a-b),我们采用门控照明(详见 “方法”)对单个 U2OS 细胞进行了 10 分钟的时间序列成像:
- 与标准共聚焦显微镜(四象限求和)相比,CRM 能更清晰地分辨 U2OS 细胞线粒体的形态动态,可更明确地观察到线粒体融合事件(图 5b 及补充视频 2)和分裂事件(扩展数据图 2 及补充视频 3),其时间尺度与以往报道 ¹² 一致;
- 需注意,四象限探测器中的集成前置放大器限制了最大像素速率(约 2 MHz),但即便如此,仍可实现 30 Hz 帧率的 256×256 像素图像成像(补充视频 4)。
在活水母成像中,我们采用连续照明:从提取的帧(图 5c-d)和完整视频(补充视频 5、6)可见,CRM 能分辨两个神经元胞体运动动态中的更精细特征。此外,如扩展数据图 4 所示,CRM 不仅提升了空间分辨率,还提高了信背比(SBR)—— 原因在于 CRM 将信号结构重分配到更小区域,而背景(多为均匀分布)不会产生质心位移,因此基本保持不变。
CRM 实现扩展景深(EDOF)成像
实际应用中,通常会适当缩小 CRM 的针孔,以利用与针孔尺寸相关的光学切片能力。若针孔大幅打开,光学切片能力会减弱,离焦信号会入射到四象限探测器,导致发射 PSF 展宽,进而需增大质心计算所需的缩放因子 S。
由于本文中缩放因子 S 的估计基于四象限图像互相关(详见 “方法”),CRM 可自适应调整以补偿此类 PSF 展宽;且由于该估计为局部操作,重分配缩放因子可在样本中动态变化 —— 若样本不同区域离焦程度不同,CRM 能自适应校正。因此,即便样本存在深度变化,CRM 仍能清晰呈现精细结构:扩展数据图 3 显示,共聚焦图像中明显的离焦模糊,在 CRM 成像中基本得到补偿,且补偿范围覆盖 10 μm 深度。
综上,CRM 对离焦像差具有稳健性,具备实现扩展景深(EDOF)成像的潜力。更广泛地说(尽管本文未展示),只要像差不会导致发射 PSF 的质心整体偏移,CRM 对更普遍的像差均具有稳健性。
讨论
显微镜分辨率的表征可采用多种指标 ³⁶,既包括傅里叶域指标(如阿贝极限),也包括像素域指标(如瑞利极限):
- 前者在观察图像强度谱时通常更直观(如图 2c 所示);
- 后者用于表征两个发射器的分离能力,对生物成像更具实际意义 —— 因生物成像中关注的细胞器多为局部分布。
本文已证实,CRM 在发射器分离能力上优于共聚焦显微镜和 ISM:
- 与共聚焦显微镜相比,CRM 结构简单,可作为附加模块集成到任何传统共聚焦显微镜中(只需后者配备 4 通道电子设备),且核心优势在于无需闭合针孔,因此保持了完整的探测效率,即便在低光条件下(如高速成像或低激发功率场景,活样本成像常需此类条件)也能维持高 SNR;
- 与 ISM 相比,CRM 使用的探测器数量更少,简化了探测电子系统并降低了电子噪声,且在相同光子预算下能获得更锐利的图像。
但 CRM 也存在局限性,主要包括两方面:
- 非线性特性:CRM 成像过程具有非线性,无法用与 PSF 的卷积来描述,且非线性程度随重分配参数 α 增大而增强。一方面,正是这种非线性实现了更强的发射器分离能力,使图像比 ISM 更锐利;另一方面,若需保证图像线性,可能需降低 α 值,直至 CRM 与 ISM 图像效果相近。
- 光学切片能力减弱:CRM(与 ISM 类似)因避免使用针孔,牺牲了针孔带来的核心优势 —— 光学切片能力。实际应用中发现,CRM 与 “未完全打开的针孔” 搭配使用效果最佳:既可保留一定的光学切片能力,又不会过度牺牲探测效率。此外,针孔的存在还能平滑 CRM 图像(降低 α 值也有类似效果)。当然,某些场景下可能恰好需要较弱的光学切片能力(如减少轴向样本运动引起的伪影),此时 CRM 仍能保持高分辨率,因其本身对离焦像差具有稳健性。
近年来,已有研究报道基于图像后处理 ³⁷⁻³⁹或机器学习⁴⁰⁴¹ 的单帧 / 少帧增强分辨率成像技术(适用于传统荧光团)。需强调的是,当前版本的 CRM 无需依赖样本先验知识,尽管未来版本可能通过结合此类技术进一步提升性能。此外,还可考虑减少探测通道数量(如使用 3 元素探测器或真正的非像素化质心探测器),以进一步简化 CRM 硬件。
综上,CRM 兼具简单性与广泛适用性,有望成为生物成像领域的通用技术,为科研人员提供活样本超分辨成像的新选择。
参考文献
- Mouli, P. K., Twig, G. & Shirihai, O. S. 线粒体融合的频率与选择性是其质量维持功能的关键. 生物物理杂志 96, 3509–3518 (2009).
- Twig, G. 等。分裂与选择性融合调控线粒体分离及自噬清除. 欧洲分子生物学组织杂志 27, 433–446 (2008).
- Hirokawa, N., Noda, Y., Tanaka, Y. & Niwa, S. 驱动蛋白超家族马达蛋白与细胞内运输. 自然综述・分子细胞生物学 10, 682–696 (2009).
- Maday, S., Twelvetrees, A. E., Moughamian, A. J. & Holzbaur, E. L. F. 轴突运输:货物特异性运动机制与调控. 神经元 84, 292–309 (2014).
- Kasai, H., Fukuda, M., Watanabe, S., Hayashi-Takagi, A. & Noguchi, J. 树突棘在记忆与认知中的结构动态. 神经科学趋势 33, 121–129 (2010).
- Nägerl, U. V., Willig, K. I., Hein, B., Hell, S. W. & Bonhoeffer, T. 基于 STED 显微镜的树突棘活细胞成像. 美国国家科学院院刊 105, 18982–18987 (2008).
- Small, J. V., Stradal, T., Vignal, E. & Rottner, K. 片足:运动起始之地. 细胞生物学趋势 12, 112–120 (2002).
- Barbieri, J. T., Riese, M. J. & Aktories, K. 修饰肌动蛋白细胞骨架的细菌毒素. 细胞与发育生物学年度评论 18, 315–344 (2002).
- Schermelleh, L. 等。超分辨显微镜解析. 自然细胞生物学 21, 72–84 (2019).
- Hofmann, M., Eggeling, C., Jakobs, S. & Hell, S. W. 利用可逆光切换蛋白实现低光强下突破衍射极限的荧光显微镜成像. 美国国家科学院院刊 102, 17565–17569 (2005).
- Betzig, E. 等。细胞内荧光蛋白的纳米分辨率成像. 科学 313, 1642–1645 (2006).
- Rust, M. J., Bates, M. & Zhuang, X. 基于随机光学重建显微镜(STORM)的亚衍射极限成像. 自然方法 3, 793–796 (2006).
- van de Linde, S. 等。基于标准荧光探针的直接随机光学重建显微镜. 自然实验方案 6, 991–1009 (2011).
- Sharonov, A. & Hochstrasser, R. M. 基于扩散探针累积结合的宽场亚衍射成像. 美国国家科学院院刊 103, 18911–18916 (2006).
- Jungmann, R. 等。基于 DNA 折纸的单分子动力学与超分辨显微镜成像(通过荧光成像瞬态结合). 纳米快报 10, 4756–4761 (2010).
- Dertinger, T., Colyer, R., Iyer, G., Weiss, S. & Enderlein, J. 快速、无背景的三维超分辨光学波动成像(SOFI). 美国国家科学院院刊 106, 22287–22292 (2009).
- Balzarotti, F. 等。最小光子通量下荧光分子的纳米分辨率成像与追踪. 科学 355, 606–612 (2017).
- Hell, S. W. & Wichmann, J. 基于受激发射突破衍射分辨率极限:受激发射损耗荧光显微镜. 光学快报 19, 780–782 (1994).
- Gustafsson, M. G. L. 利用结构光照明显微镜将横向分辨率提升 2 倍. 显微镜杂志 198, 82–87 (2000).
- Heintzmann, R. & Huser, T. 超分辨结构光照明显微镜. 化学评论 117, 13890–13908 (2017).
- Mangeat, T. 等。基于随机照明显微镜的超分辨活细胞成像. 细胞报告方法 1, 100009 (2021).
- Sheppard, C. J. R. 共聚焦成像中的超分辨. 光学 80, 53–54 (1988).
- Müller, C. B. & Enderlein, J. 图像扫描显微镜. 物理评论快报 104, 198101 (2010).
- Huff, J. 蔡司 Airyscan 探测器:信噪比提升与超分辨共聚焦成像. 自然方法 12, i–ii (2015).
- Roth, S., Sheppard, C. J., Wicker, K. & Heintzmann, R. 光学光子重分配显微镜(OPRA). 光学纳米显微术 2, 5 (2013).
- De Luca, G. M. R. 等。重扫描共聚焦显微镜:两次扫描实现更高分辨率. 生物医学光学快报 4, 2644 (2013).
- York, A. G. 等。基于模拟图像处理的活细胞与胚胎即时超分辨成像. 自然方法 10, 1122–1126 (2013).
- Azuma, T. & Kei, T. 基于光学光子重分配的超分辨旋转盘共聚焦显微镜. 光学快报 23, 15003–15011 (2015).
- Tortarolo, G. 等。聚焦图像扫描显微镜:锐利且温和的超分辨显微镜. 自然通讯 13, 7723 (2022).
- Zunino, A. 等。开源工具助力图像扫描显微镜数据的便捷与高级分析. 自然光子学 17, 457–458 (2023).
- Buttafava, M. 等。用于图像扫描显微镜的基于 SPAD 的异步读出阵列探测器. 光学 7, 755–765 (2020).
- Radmacher, N. 等。结合图像扫描显微镜将荧光寿命单分子定位显微镜分辨率提升 2 倍. 自然光子学 18, 1059–1066 (2024).
- Zunino, A. 等。用于激光扫描显微镜中同时超分辨与光学切片的结构探测. 自然光子学 1–10 (2025) doi:10.1038/s41566025-01695-0.
- Sheppard, C. J. R. & Wilson, T. 扫描显微镜中的互易性与等效性. 美国光学学会志 A 3, 755–756 (1986).
- Castello, M., Sheppard, C. J. R., Diaspro, A. & Vicidomini, G. 基于四象限探测器的图像扫描显微镜. 光学快报 40, 5355–5358 (2015).
- Nieuwenhuizen, R. P. J. 等。光学纳米显微镜中图像分辨率的测量. 自然方法 10, 557–562 (2013).
- Gustafsson, N. 等。基于超分辨径向波动的 ImageJ 快速活细胞传统荧光团纳米显微镜. 自然通讯 7, 12471 (2016).
- Torres-García, E. 等。单帧成像内的分辨率提升. 自然通讯 13, 7452 (2022).
- Zhao, B. & Mertz, J. 基于像素重分配去模糊的分辨率提升. 先进光子学 5, 066004 (2023).
- Qiao, C. 等。光学显微镜中图像超分辨深度神经网络的评估与开发. 自然方法 18, 194–202 (2021).
- Chen, R. 等。用于细胞内动态成像的单帧深度学习超分辨显微镜. 自然通讯 14, 2854 (2023).
图表说明
图 1 扫描显微镜不同类型的原理

a. 通用示意图 —— 下方插图展示二维光栅扫描的单条扫描线,覆盖位于同一 y 坐标的两个荧光团。b、c. 所得 I (xₑₓ, xₑₘ) 的模拟结果(假设激发与发射 PSF 为高斯型且尺寸相同,蓝色填充高斯曲线代表扫描激发)。本例中,荧光团间距为 PSF 尺寸的一半。
b. I (xₑₓ, xₑₘ) 沿水平和垂直方向的投影(灰色箭头所示)得到等效宽场图像;沿反对角线投影(绿色箭头所示)得到分辨率提升的 ISM 图像。需注意,理想共聚焦显微镜(针孔闭合)的图像与 ISM 图像相似,但信号强度弱得多。
c. CRM 原理:用质心探测器替代阵列探测器,对于每个激发扫描位置 xₑₓ,将探测到的总强度重分配(白色箭头)至 xₑ
ₓ与发射质心 x̂ₑₘ(青色曲线)之间的位置 xᵣ(红色曲线)。上方显示宽场(灰色)、理想共聚焦(蓝色)和 CRM(红色)图像的归一化轮廓。
图 2 基于质心探测器的 CRM 图像形成

a. 经过适度打开的针孔(1.05 AU,图中未显示)的发射光,聚焦到微透镜阵列(LA)上,由四象限硅光电倍增管(SiPM)阵列探测。扫描过程中,四象限探测器获取 4 幅原始图像,作为 CRM 处理流程的输入。
b. 对于每个激发扫描位置 ρₑₓ,从原始图像中计算发射总强度 I_conf 和质心位置 ρ̂ₑₘ={x̂ₑₘ, ŷₑₘ},并用于执行 CRM(细节见 “方法”)。
c. 固定 BPAE 细胞中抗 α- 微管蛋白标记的微管,分别由标准共聚焦显微镜(左,四象限求和)和 CRM(右)成像。插图显示空间频率(对数尺度)。比例尺:1 μm。
d. c 中白色方框区域的放大图。比例尺:500 nm。
e. d 中白色箭头所示区域的强度轮廓。
f. 标准共聚焦(红色)与 CRM(蓝色)的 FRC 分析。橙色虚线表示用于定义分辨率的常规 FRC 阈值。实验独立重复 3 次,结果一致。
图 3 重分配因子对双色 CRM 与 ISM(蔡司 LSM980 Airyscan2)分辨率的影响对比

a. 固定 BPAE 细胞中,Alexa Fluor 488 鬼笔环肽标记的 F - 肌动蛋白(绿色)与 MitoTracker Red CMXRos 标记的线粒体(品红色)的双色序贯成像,分别由 Airyscan(左,探测区域 1.25 AU)和 CRM(右,针孔 1.05 AU)获取。比例尺:3 μm。
b. 不同重分配因子(α=0、1/2、1)下,a 中白色方框区域的放大图。白色箭头所示区域的强度轮廓按 α 值进行颜色编码。注:CRM 的图像锐利度随 α 增大而提升,而 ISM 在 α≈1/2 时锐利度最高。比例尺:800 nm。
c. F - 肌动蛋白图像中,由 FRC 分析得到的空间分辨率随重分配因子(0 至 1)的变化。橙色虚线表示用于定义分辨率的常规 FRC 阈值。实验独立重复 3 次,结果一致。
图 4 CRM 分辨率提升及抗噪声能力验证

a. Alexa 488 鬼笔环肽标记的 BPAE 细胞 F - 肌动蛋白图像对比,分别由 CRM 和 Airyscan 获取。从下逆时针依次为:Airyscan 求和模式(共聚焦 1.25 AU)、Airyscan 中心通道仅(共聚焦 0.2 AU)、Airyscan 超分辨模式(无反卷积)、CRM(针孔 1.05 AU)。比例尺:3 μm。
b. a 中白色方框区域的放大图,照明功率逐渐增加(1× 对应样本处 1.25 μW,分辨率分别为:CRM:206 nm±39 nm;Airyscan:327 nm±44 nm;共聚焦 1.25 AU:541 nm±104 nm;共聚焦 0.2 AU:908 nm±65 nm)。每个面板右上角的插图显示白色箭头所示区域的归一化强度轮廓。比例尺:500 nm。
c. 对 a 中 8 个不同感兴趣区域(ROI)的 FRC 分析分辨率统计结果取平均值。实验独立重复 3 次,结果一致。
图 5 CRM 的活样本成像

a. 表达 EGFP 标记线粒体外膜蛋白(TOM20-EGFP)的活 U2OS 骨肉瘤细胞线粒体动态。视场(FOV):16 μm×16 μm。比例尺:3 μm。完整视频见补充视频 1。常规共聚焦图像(针孔 1.05 AU)由原始四象限图像求和得到。
b. a 中白色方框区域的线粒体融合时间序列。白色箭头所示区域的归一化强度轮廓。比例尺:1 μm。完整视频见补充视频 2。
c. 表达 mCherry 的活水母(半球美螅水母)RFamide 神经元动态。视场:49 μm×49 μm。比例尺:11 μm。完整视频见补充视频 5。
d. c 中白色方框区域的神经元胞体与神经突起时间序列。白色箭头所示区域的归一化强度轮廓。比例尺:4 μm。完整视频见补充视频 6。
致谢
感谢扎希德・亚库布(Zahid Yaqoob)借出 1.42 NA/60× 物镜,卢逸飞(Yifei Lu)协助完成 Airyscan 实验,弗朗西斯科・桑切斯(Francisco Sanchez)与胡瑞峰(Ruifeng Hu)协助样本保存,王天予(Tianyu Wang)就数据采集系统设计提供有益讨论,以及王天予与田雷(Lei Tian)参与早期理论讨论。本研究部分得到美国国家科学基金会(NSF)合作协议(EEC1647837)和美国国立卫生研究院(NIH)资助项目(R01NS116139、R01EB029171)支持。
作者信息
现任地址
赵健(J.Z.):美国俄克拉荷马州诺曼市俄克拉荷马大学生物医学工程学院,邮编 73019。
作者贡献
杰罗姆・默茨(J.M.)与李川(C.L.)提出研究项目;李川设计并搭建实验系统,与赵冰莹(B.Z.)、李云哲(Y.L.)讨论后编写并开发重建算法;黎泉(Q.L.)、朱利安・O・木村(J.O.K.)、赵健制备实验样本;李川在黎泉、朱利安・O・木村协助下开展成像实验;李川处理数据;李川、黎泉、朱利安・O・木村、赵冰莹、李云哲分析数据;李川与杰罗姆・默茨进行模拟;李川与杰罗姆・默茨撰写论文;所有作者审阅手稿;杰罗姆・默茨、约翰・T・吴(J.T.N.)、布兰登・维斯鲍德(B.W.)、托马斯・比法诺(T.B.)负责项目监督。
竞争利益
杰罗姆・默茨(J.M.)、李川(C.L.)、赵冰莹(B.Z.)已就本文所述 CRM 方法向波士顿大学提交技术披露。
补充信息
本文提供补充信息。
通信与材料获取
通信及材料获取请联系李川(电子邮箱:chuanli1@bu.edu)与杰罗姆・默茨(电子邮箱:jmertz@bu.edu)。
